您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-05-22 12:06
在这个谈癌色变的时代,如果作为治疗或诊断使用的医疗器械,出现了致癌性,小编相信这绝对是所有厂商都不愿承担的风险。因此,对于可能致癌的产品,为了保证使用的安全性,厂商都需要开展致癌性测试。所以,小编今天将和大家一起解读ISO 10993-3:2014标准要求,讨论如何检测产品的致癌性。
致癌性测试概述
ISO 10993-3:2014讨论了在测试动物的主要寿命期内,评估医疗器械、材料或其浸提物致癌性的过程和方法。一般来说,致癌性问题有可能通过风险评估来解决,可用的方法包括杂质和浸提物的化学鉴定、患者接触、证据权重(WOE)和作用方式(MOA)等。例如,可以通过文献检索来获取材料的致癌性信息,以选择适合的暴露途径和时间。
但是需要说明的是,在没有任何重大患癌风险的情况下,致癌性测试其实比较少用于评估医疗器械。除非有确切的信息证明,需要对最终医疗器械进行致癌性测试,才会选用全生命期研究或转基因模型进行试验。
测试策略
大多数情况下,对于遗传毒物质,都要考虑致癌性的风险。如果是非遗传毒性物质,在两种情况下需要考虑致癌性测试:1)材料的降解时间超过30天;2)在体内或人体腔道内,引入的材料累积接触超过30天。
但是,如果是以下情况,则需进一步判断:1)在人类使用方面有充足数据(如患者群体、治疗部位、不良事件、患癌风险等)的材料;2)会引起肿瘤实体化的材料;3)方法学受限或其它试验预测值受限的情况。总之,在考虑是否应进行致癌性测试时,要尽可能明确该研究在评估人类风险方面的作用,并证明测试的必要性。
样本制备
进行致癌性测试时,选用的样本可以是:来源最终产品的材料、确定的化学物质或特定的浸提物。一般来说,应选用最终产品的代表形式进行检测。如果是产品的其他状态,例如器械自身产生的磨损碎屑或原位固化的材料(如骨水泥、粘合剂和预聚物混合物),也可以用于测试,但是要遵循10993-12:2012标准要求,具体内容可阅读往期推文“ISO 10993-12:2012 样本制备及参考品标准解读”。
需要注意的是,动物试验中使用的最高剂量为最大耐受剂量,或根据动物模型调整后的剂量,该剂量应选用人体最大暴露剂量的整数倍(重量或表面积/千克)。
测试方法
关于测试方法的选择,通常会考虑致癌性测试是否与慢性毒性测试相关。如果相关,则需另外参考指南文件OECD TG 453,否则需参考OECD TG 451。那么,这两份指南文件到底有何来头?又包括哪些内容呢?小编在此跟大家做简单介绍。
指南文件OECD TG 453介绍
OECD (Organization for Economic Cooperation and Development)全称为经济合作及发展组织,简称经合组织。该组织会定期收集成员国的一些行业数据,制订并发布相关指南文件,用于指导行业发展。其中,TG 453就属于化学物测试的指南文件之一。该指南最早发布于1981年,主要用于指导测试各类化学品,包括农药和工业化学品。
因为大多数慢性毒性和致癌性研究是在啮齿类动物中进行,所以该指南文件也主要适用于此类研究。通常,用于慢性毒性/致癌性研究的给样途径有三种:口服、皮肤和吸入。给样途径的选择,取决于测试样本的理化性质以及与人的接触途径。本指南重点介绍用于慢性毒性和致癌性研究的最常用途径——口服途径。
TG 453总共分为6个章节,内容框架可见下表。该测试指南的研究目标包括:1)与对照组相比,确定化学品的致癌性质,例如肿瘤发病率增加、恶性肿瘤比例增加、或肿瘤出现时间缩短;2)确定肿瘤出现的时间;3)确定化学品的慢性毒性;4)鉴定慢性毒性和致癌性的靶器官;5)量效表征;6)明确未观察到的不利影响水平(NOAEL)或建立基准剂量起始点(BMD);7)根据低剂量人体接触水平推断致癌作用;8)预测慢性毒性效应;9)提供数据以验证相关假设。
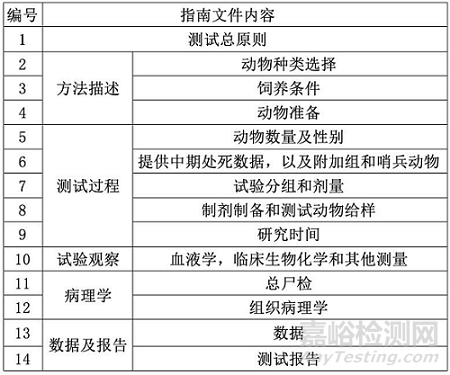
指南文件OECD TG 451介绍
测试指南OECD TG 451适用于只跟致癌性相关的测试。与OEVD TG 453相比,该指南文件的发布时间、应用领域、适用动物、研究途径、研究目的和内容框架都基本一致,只是在试验观察项上,TG 451加入了对体重、食物/水消耗的监测。但是,在试验设计和内容上,二者的差异是很大的。大家可以根据产品特点和测试需要,再仔细研读这两份指南文件。
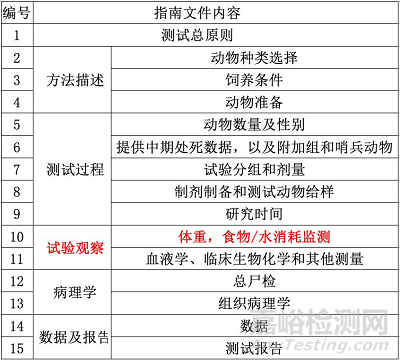
除了OECD TG 451和 OECD TG 451提供的测试方法外,大家还要了解植入测试方法。因为,对于使用材料浸提液或特定化学物质开展的致癌性测试,厂商通常需要回答一个问题,即“为什么材料的表面特性不需要纳入考虑”。其实厂商可以通过植入研究,进一步评估材料表面特性可能对人体造成的危害和风险。
研究表明,肿瘤通常会长在植入物附近,其生长频率取决于以下因素:1)植入物尺寸(尺寸大的植入物会产生更多肉瘤);2)植入物形状;3)植入物的光滑程度(粗糙的植入物会产生更多肉瘤);4)植入物表面积的连续性(植入物表面孔洞越大,肿瘤发生几率越低);5)植入物保留在体内的时间。
另外,要特别注意的是,材料的植入量应远远大于人体最大暴露剂量,以提供足够的安全边际。在考虑动物模型生理限制的前提下,应将人体最大暴露量(体重或表面积/每千克)的100倍(安全系数)作为植入剂量。当然,阴性对照组通常会选用形状相似、无致癌性且临床上可接受的材料(例如,聚乙烯)。
近些年,有些研究者使用转基因模型(如rasH2转基因小鼠模型)来评估致癌性。因为转基因模型可以有效缩短试验周期(通常为6个月,正常模型为2年),而且能够减少动物用量,所以获得了业界的一定认可,但目前还没有真正应用于医疗器械的致癌性评估。
总结
通过全文介绍,关于如何开展致癌性测试,相信大家有了一定了解。总而言之,首先要基于风险评估工作,判断是否有开展致癌性测试的必要性。然后,要根据致癌性与慢性毒性是否相关,选用合适的参考标准和指南文件。最后,依据产品理化性质及临床使用途径,按照标准和指南要求,开展致癌性测试。
参考资料:
[1] ISO 10993-3:2014 Biological evaluation of medical devices -- Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity
[2] OECD Guidelines for the Testing of Chemicals, Section 4,Test No. 453: Combined Chronic Toxicity/Carcinogenicity Studies
[3] OECD Guidelines for the Testing of Chemicals, Section 4,Test No. 451: Carcinogenicity Studies

来源:AnyTesting


