您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-06 16:11
近日,苏州同心医疗科技股份有限公司宣布其自主研发的新一代全磁悬浮左心室辅助系统BrioVAD™获得美国FDA批准开展临床试验,该里程碑式临床试验INNOVATE研究已获得FDA临床试验器械豁免许可(IDE),可以附条件启动患者招募。
该研究将评估由同心医疗自主研发的新型全磁悬浮左心室辅助系统BrioVAD™用于治疗难治性心力衰竭的有效性和安全性。与此同时,同心医疗已经召开了首次研究者会议并开始了美国临床试验中心的相关启动工作。
BrioVAD™左心室辅助系统是在公司明星产品慈孚®️VAD上进行升级迭代,在2023国家高性能医疗器械创新生态峰会上,同心医疗凭借其自主研发的全磁悬浮人工心脏——慈孚®植入式左心室辅助系统(简称“慈孚®VAD”)荣登“2023十大自主创新医疗器械产品”榜单,成为唯一一个成功入选的人工心脏企业。
BrioVAD™左心室辅助系统
同心医疗此次在美国获批的BrioVAD™左心室辅助系统,在现有产品慈孚®️VAD(型号:CH-VAD)出色的血液相容性基础上,通过多项技术创新实现了体外携带部件的便携化,且系统整体性能获得进一步提升。同时,INNOVATE研究将采用随机对照方案,将BrioVAD™与之前获FDA批准的产品进行对比评估。
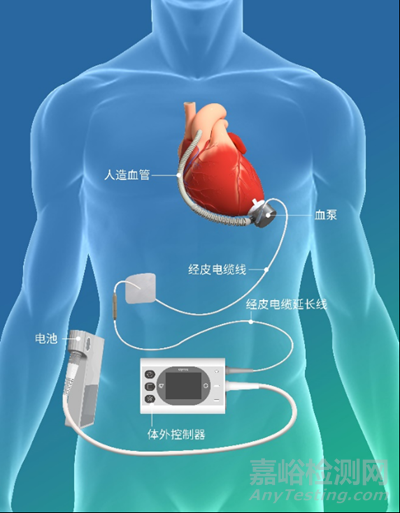
▲左心室辅助系统BrioVAD™产品示意图
慈孚®植入式左心室辅助系统(CH-VAD)是我国自主研发的首个获批的全磁悬浮植入式左心室辅助装置,由阜外医院团队和同心医疗团队联合开发,重量186g,血泵直径50mm,厚度26mm,最大流量为10L/mim。
该产品的核心技术主要为全磁悬浮血泵技术,目前取得中国和美国多项专利,属于国内首创医疗器械。与国际同类产品相比,关键性能指标已达到同等水平,血泵尺寸更小,植入侵犯性更优。
慈孚®VAD于2018年进入临床,于2021年获得NMPA批准与特定人工血管配套使用,为进展期难治性左心衰患者血液循环提供机械支持,用于心脏移植前或恢复心脏功能的过渡治疗。

▲慈孚®植入式左心室辅助系统(CH-VAD)
慈孚®VAD植入式左心室辅助系统由体内植入部件、体外携带部件、外围部件、专用手术工具组成,是一种用于部分替代心脏完成泵血功能、维持人体血液循环的机电一体化装置。其核心部件是一个血泵,将血液从心脏引出,提升压力后,输送到主动脉,从而达到卸载天然心脏负荷的功能,使天然心脏得到休息,同时补充了天然心脏泵血能力不足的问题。
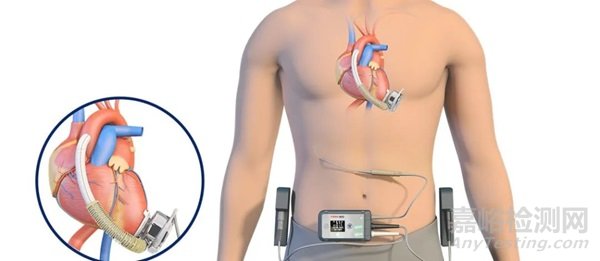
慈孚®VAD自上市以来,已经在全国40多家心脏病顶级医院的180余位患者中获得应用,首例患者已生存超过6年并持续保持高质量生活。慈孚®VAD拥有从底层核心技术开始搭建的完备自主知识产权,已经在中国、美国、欧洲和日本等国家和地区获得专利保护。
慈孚®VAD最新临床数据
2024年4月,在ISHLT的“Spin Doctors and Heart Hotties: Unleashing the Future of MCS Devices”专题上,中国医学科学院阜外医院王现强教授首次携慈孚®VAD长期随访结果登上国际舞台。在该项单中心、回顾性、观察性研究中,接受慈孚®VAD治疗的终末期心衰患者生存率高,并发症率低,无一例泵血栓、致残性卒中或主要器械故障。
研究目的:
为进一步评估慈孚®VAD的长期有效性与安全性,阜外医院开展了该项单中心、回顾性、观察性研究,纳入2017年6月至2023年8月于该中心接受慈孚®VAD治疗的心衰患者,对其临床数据及长期预后情况进行了统计分析。
研究方法:
该研究共纳入50例患者,随访时长在3个月-6.7年之间。患者平均带泵支持时间2.4年,50例患者均成功接受LVAD植入,术中及术后患者血泵运行稳定,血流动力学恢复正常。
研究结果:
采用Kaplan-Meier生存分析,患者1年、2年、3年生存率分为93%、93%、89%,均高于国际临床研究及真实世界水平。50例患者中,仅有2例患者桥接心脏移植。3例患者心脏功能完全恢复并移除LVAD。
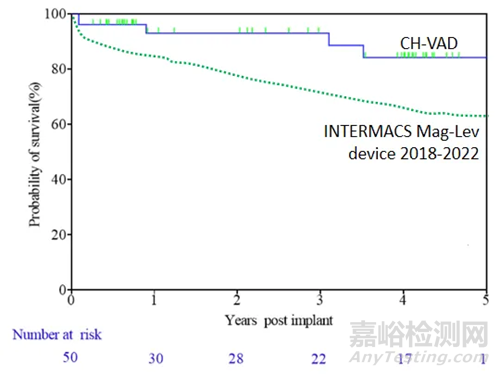
▲随访期间患者生存率
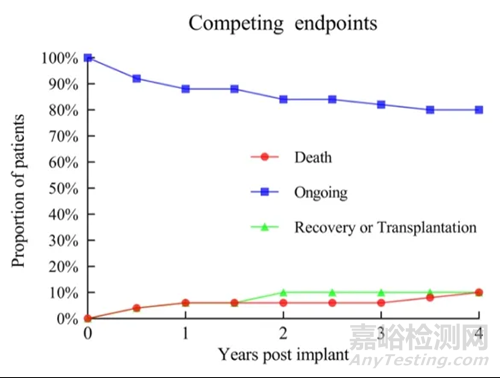
▲不同终点事件发生率
该研究中,不良事件的总体发生率较低。慈孚®VAD卓越的血液相容性得以体现,未观察到一例泵血栓形成、溶血或致残性卒中事件发生。
所有患者中,仅有2例发生缺血性卒中(0.02 /人-年),1例发生出血性卒中(0.01/人-年),且患者神经功能均在随访期间恢复。发生率最高的不良事件为术后感染,随着团队综合管理经验的积累,此类不良事件得到有效预防和控制,绝大多数患者在多学科团队的管理下取得了良好预后。随访期内无主要器械故障和换泵手术发生,提示器械长期可靠性高。
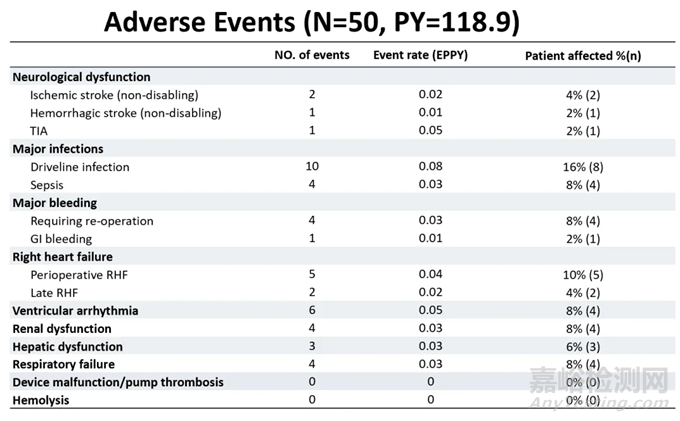
▲各类不良事件发生率
慈孚®VAD对比HeartMate
2024年4月15日,美国食品药品监督管理局(FDA)在其官方网站公布通告,因外力导致的人工血管阻塞事件(Entrinsic Outflow Graft Obstruction, 简称EOGO),Abbott/Thoratec决定召回HeartMate II和HeartMate 3植入式左心室辅助系统。本次召回事件涉及器械13883套,占此前市场产品总量的56%,HeartMate 3 EOGO的Kaplan Meier预估发生率为2年0.24%,5年2.06%。
此次召回中涉及的HeartMate II和HeartMate 3的EOGO,在业内并非是“新闻”。到目前为止,美国FDA已经收录了多起HeartMate关于EOGO的不良事件报告,共计有273例伤害事件和14例死亡事件报告。
需要说明的是:其一、美国FDA对医疗器械的一级召回事件并不意味着产品的停产停用,而是针对产品存在的问题进行修正处理,并会继续投入临床使用;其二、美国FDA对于HeartMate II和HeartMate 3的一级召回原因是EOGO事件,EOGO是由于HeartMate II和HeartMate 3的人工血管被致密加强套管包裹,导致渗出的非细胞生物物质堆积,人工血管被迫向内挤压引起,而以慈孚®VAD为代表的国内LVAD器械已通过加强套管的镂空设计,解决了HeartMate存在的上述设计缺陷。
▲慈孚®VAD设计
全磁悬浮技术在无液体条件下即可实现稳定空转,大量研究已证实其能显著减少血液损伤,进而显著减少血栓、卒中等相关并发症的发生。
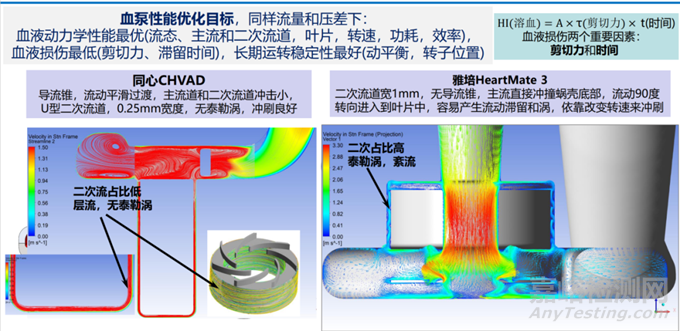
慈孚®VAD通过将电机定子和磁悬浮定子分别布置在转子的内外侧,保证了其在X、Y轴的平动和转动以及Z轴平动共5个自由度上的悬浮稳定,使其具有良好的抗冲击效果,长期运行也更稳定,减少了对血液的损伤;同时优化的流道设计,使血流通过鼻锥引流,从入口管平滑过渡到叶轮位置,间隙250μm的U型二次流道既不会太窄导致导致血液无法顺畅流动,也不会因为太宽而产生泰勒涡,保证了良好冲刷效果。
北京航空航天大学陈增胜教授也曾强调:导致本次召回的“罪魁祸首”在于HeartMate II和HeartMate 3致密PTFE材质加强套管,而以同心医疗慈孚®VAD为代表的国内LVAD器械已通过镂空式加强套管设计很好地解决了人工血管挤压问题。
公司及创始人
苏州同心医疗科技股份有限公司(简称“同心医疗”)成立于2008年,由海外科技专家团队归国创立,总部位于中国苏州,公司专注于研究开发国际领先的心室辅助装置(人工心脏),推动人工心脏在全球范围实现商业化与销售,造福广大的终末期心衰患者。
经过10多年的独立研发,凭借在全磁悬浮人工心脏领域的技术积累,同心医疗已开发完成了基于全磁悬浮技术的新一代人工心脏CH-VAD®,并在这一新兴细分领域,持续展现出全球技术领跑者的实力。
公司创始人陈琛博士是清华大学热能工程学士,四川大学生物医学工程博士,日本东京大学访问学者,日本茨城大学博士后研究员。现为苏州大学教授,国家级重大领军人才计划入库专家,中国生物医学工程学会机械循环支持分会常务理事。陈博士曾担任美国NIH项目、“十一五”国家863计划重点项目、科技部国际科技合作与交流专项、“十二五”863计划主题项目课题等多个高层次、高资助强度研究项目负责人。
陈博士自1996年以来主要从事人工心脏领域的技术研发和企业管理,曾从事基于磁悬浮技术的人工心脏Levacor™研发,发明了一种磁悬浮装置,提出了多学科设计优化的有效方法,为Levacor成为当时的一项重要技术成就作出了决定性贡献。

来源:心未来


