今日头条
迈威Nectin-4靶向ADC上III期临床。迈威生物Nectin-4 ADC创新药9MW2821登记启动一项III期临床,拟评估9MW2821对比研究者选择的化疗治疗既往接受过含铂化疗和PD -(L)1抑制剂治疗的无法手术切除的局部晚期或转移性尿路上皮癌的效果。该项试验主要研究者由复旦大学附属肿瘤医院医学博士叶定伟担任。在II期临床中,9MW2821单药治疗的客观缓解率和疾病控制率分别为62.2%和91.9%。
国内药讯
1.科越C5/FH1-5补体抑制剂Ⅱ期临床积极。科越医药在ASH2023年会上公布其C5/FH1-5双靶点补体抑制剂KP104一线治疗阵发性睡眠性血红蛋白尿症(PNH)的II期试验积极结果。中期数据显示,所有接受KP104治疗患者(100%)的血红蛋白水增加≥2g/dL,其中有56%患者达到血红蛋白正常化(≥12g/dL);83%患者的LDH水平持续低于1.5x ULN,72%患者的LDH水平维持在1x ULN以下。临床中未发生3级或以上的治疗相关不良事件(TEAEs)。
2.亘喜FasTCAR-T疗法最新临床数据积极。亘喜生物在ASH2023年会上公布其靶向BCMA/CD19双靶点自体FasTCAR-T产品GC012F一线治疗多发性骨髓瘤(NDMM)的临床试验(IIT)最新结果。中位随访为18.8个月时,GC012F治疗达到100%的总体应答率(ORR)和95%的微小残留病灶阴性(MRD-)严格完全缓解(sCR)率;中位缓解持续时间(DOR)和中位无进展生存期(PFS)均未达到。临床中未出现新的安全性信号。
3.神曦AAV基因疗法获胶质瘤孤儿药资格。神曦生物自研AAV基因治疗产品NXL-004获FDA授予孤儿药资格,用于治疗恶性胶质瘤。NXL-004是神曦生物利用其原位神经再生技术平台开发的创新型基因治疗药物。原位神经再生技术是通过病毒或非病毒载体将神经转录因子递送到病变部位,使得受损神经元周围的星形胶质细胞向神经元进行转分化。该产品拟开发用于治疗胶质瘤。
4.通化东宝GLP-1/GIP激动剂获批临床。通化东宝1类化药注射用THDBH120获国家药监局临床试验默示许可,拟开发用于治疗2型糖尿病。THDBH120是一款GLP-1/GIP双靶点激动剂,其将GLP-1和GIP这两种促胰岛素的作用整合至一个多肽单分子中,且通过进一步分子设计提高代谢稳定性,改善血糖控制。目前,礼来开发的同靶点药物Tirzepatide已获得FDA批准上市,用于治疗2型糖尿病,以及治疗肥胖或超重患者。
5.百利天恒HER3/EGFR双抗ADC授权BMS。百利天恒药业子公司SystImmune宣布与百时美施贵宝就其临床后期HER3/EGFR双抗ADC新药BL-B01D1达成合作许可协议,两家公司将在美国共同开发和商业化BL-B01D1,用于治疗一系列实体瘤(包括NSCLC和乳腺癌)。根据协议,SystImmune将获得8亿美元的预付款,开发、监管和销售里程碑后期付款,总潜在交易金额高达84亿美元。百时美施贵宝将负责BL-B01D1的全球(中国以外)开发和商业化。
国际药讯
1.MAGE-A4抗原靶向TCR-T疗法报滚动BLA。Adaptimmune公司已完成向FDA滚动提交其靶向MAGE-A4抗原的TCR-T产品afami-cel的生物制品许可申请(BLA),用于治疗晚期滑膜肉瘤。Ⅱ期试验SPEARHEAD-1(NCT04044768)队列1数据显示,中位随访为27.8个月时,滑膜肉瘤患者的总体缓解率(ORR)约为39%;中位反应持续时间约为12个月。12个月OS概率为90%,24个月OS概率为70%。该产品有望成为滑膜肉瘤的首创疗法。
2.诺华C3肾小球病III期临床成功。诺华口服补体B因子抑制剂iptacopan治疗C3肾小球病的III期APPEAR-C3G研究达到主要终点。与安慰剂相比,iptacopan(200mg)治疗6个月时显著改善患者的蛋白尿情形,Iptacopan的安全性与之前报告的数据一致。就在上周,该新药获FDA批准上市,成为首个口服单药疗法,用于治疗成人阵发性夜间血红蛋白尿症(PNH)。
3.罗氏/Poseida现货型CAR-T早期临床积极。Poseida公司与罗氏开发的同种异体CAR-T疗法P-BCMA-ALLO1在治疗复发/难治性多发性骨髓瘤(RRMM)的Ⅰ期临床结果积极。在接受充分淋巴细胞耗竭的强化预治疗患者中,P-BCMA-ALLO1治疗的客观缓解率(ORR)为82%(n=9/11);在既往未接受过BCMA靶向双特异性T细胞衔接抗体治疗患者的ORR则为100%。此外,药物总体耐受性良好。
4.“现货型”NK细胞组合早期临床积极。Affimed公司在ASH2023年会上公布其靶向CD16/CD30免疫细胞衔接蛋白(ICE)AFM13与同种异体自然杀伤(NK)细胞联用治疗复发/难治性霍奇金淋巴瘤(HL)的Ⅰ/Ⅱ期临床积极结果。数据显示,AFM13联合用药的总体ORR为93%,CR率为67%;在接受RP2D治疗的32例HL患者中,治疗方案的ORR为97%,CR率为78%。此外,AFM13组合总体安全性良好。
5.Editas公司CRISPR基因编辑疗法最新数据积极。Editas公司在ASH2023年会上公布其CRISPR基因编辑疗法EDIT-301(reni-cel)治疗严重镰刀型细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)的两项临床(RUBY和EdiTHAL)最新结果。在5-18个月随访期间,所有SCD患者自接受reni-cel输注后均未出现血管闭塞性事件(VOEs);在EdiTHAL试验中,患者的总血红蛋白和胎儿血红蛋白增加,总血红蛋白升高超过输血非依赖性阈值9g/dL。两项试验中,reni-cel均耐受良好。
6.Spyre公司融资推进开发IBD创新抗体。Spyre公司宣布完成1.8亿美元融资,以用于支持其炎症性肠病(IBD)治疗性抗体(SPY001、SPY002和SPY003等)进入临床开发。SPY001是一款工程化改造延长半衰期的α4β7单抗,预期2024年上半年进入首个人体研究;SPY002是一种高效选择性TL1A单抗,将于2024年下半年开展Ⅰ期临床研究;SPY003是一款靶向IL-23的p19亚基的单克隆抗体。
医药热点
1.同济大学医学院皮肤病研究所成立。为更好地开展高水平皮肤病临床诊疗、基础及临床研究工作,同济大学医学院学术委员会批准成立同济大学医学院皮肤病研究所,上海市皮肤病医院李斌院长担任研究所所长。同济大学医学院皮肤病研究所将以“临床-研究-转化-临床”模式为导向,实现“开放、流通、联合、竞争”的运行机制,深化医教协同、科教融合,建立基础研究、临床研究、转化应用于一体的医、工、研交叉创新机制,建立国内一流、国际领先的皮肤病临床诊治研究中心。
2.北京大学第六医院临床试验研究中心揭牌。近日,北京大学第六医院临床试验研究中心正式揭牌成立。此次医院成立临床试验研究中心,旨在通过整合药物临床试验机构和研究型病房,集中医院优势的临床试验、科学研究、临床诊疗等资源,更有效地开展药物和医疗器械临床试验、生物医学新技术临床应用观察等临床研究,探索新的诊疗技术和方法,更好地解决疑难危重症,提高精神疾病的诊疗水平。
3.北京积水潭医院小汤山康复中心启用。北京积水潭医院和北京小汤山医院合作共建的北京积水潭医院小汤山康复中心8日正式启用。康复中心将为北京及全国患者提供临床和康复连续性、高质量医疗服务,共同打造北京市及国家级骨科康复中心和教学科研平台。病区目前开放床位80张,计划二期开放床位200张、三期开放床位超300张。设有骨与关节康复病区、脊柱脊髓损伤康复病区及心肺重症康复病区等三个病区,主要收治骨与关节疾病或术后、中枢及周围神经损伤、脊柱脊髓损伤、心肺疾病及重症康复等患者。
评审动态
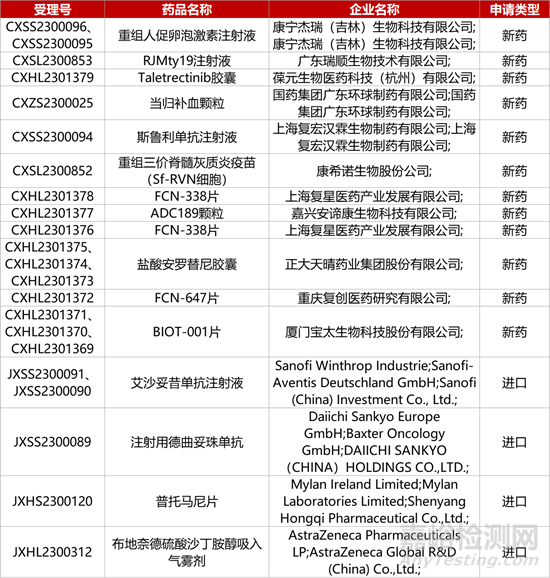
1. CDE新药受理情况(12月12日)
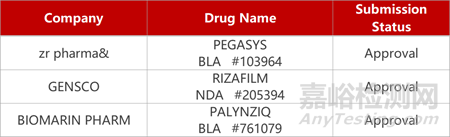
2. FDA新药获批情况(北美12月09日)