今日头条
君实/英派PARP抑制剂报产。君实生物与英派药业合作开发的聚腺苷二磷酸核糖聚合酶(PARP)抑制剂senaparib的新药上市申请获CDE受理,用于维持治疗III-IV期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者。在III期FLAMES研究中,senaparib可显著延长患者的无进展生存期。2022年8月,senaparib和替莫唑胺的固定剂量组合胶囊用于治疗小细胞肺癌已获得FDA孤儿药资格。
国内药讯
1.恒瑞JAK1抑制剂新适应症报产。恒瑞JAK1抑制剂艾玛昔替尼片(SHR0302)新适应症的上市申请获CDE受理,推测申报的适应症为治疗活动性强直性脊柱炎(AS)成人患者。在国际III期临床RSJ10333中,与安慰剂相比,接受SHR0302(8mg、4mg)治疗的特应性皮炎患者达到IGA 0/1应答的患者比例更高(42.0%和36.3%,vs9.0%)。今年6月,该新药已向CDE递交用于治疗皮炎的新药申请。
2.先声引进失眠新药启动Ⅲ期临床。先声药业从Idorsia公司引进的双重食欲素受体(orexin receptor)拮抗剂盐酸Daridorexant片登记启动一项Ⅲ期临床,拟评估用于治疗失眠性障碍中国患者的疗效和安全性。主要研究者由首都医科大学宣武医院主任医师王玉平博士担任。Daridorexan通过仅阻断促进觉醒的食欲素神经肽与其受体结合,减少唤醒驱动并诱导睡眠发生。该新药已于2022年1月在美国获批上市,商品名为QUVIVIQ。
3.天士力引进FRα-ADC获批实体瘤临床。Sutro Biopharma公司1类生物制品STRO-002注射液获CDE临床试验默示许可,拟开发用于晚期恶性实体瘤。STRO-002是一款靶向叶酸受体α(FRα)的抗体偶联药物(ADC),天士力生物拥有其中国大陆及港澳台的独家开发和商业化权益。在治疗晚期卵巢癌的Ⅰ期临床中,STRO-002的总缓解率(ORR)为37.5%,中位缓解持续时间(DOR)为5.5个月,中位无进展生存期(PFS)为6.1个月。
4.西岭源HER2-ADC获批实体瘤临床。西岭源药业旗下科岭源自主研发的注射用SMP-656获国家药监局临床试验默示许可,拟开发用于HER2表达或突变的晚期实体瘤。SMP-656是一款靶向HER2的ADC药物,采用已上市药物(艾立布林)为Payload,并利用其专有DAR4偶联技术和SuperHydra亲水性linker结合,具有更有效、更安全的开发潜力。
5.阿斯利康FRα-ADC中国报IND。阿斯利康1类生物制品AZD5335的临床试验申请获CDE受理。AZD5335是阿斯利康第3款自研ADC新药,由靶向FRα抗体与TOP1i有效载荷(AZ14170132)偶联而成,DAR值为8。在今年AACR年会上首次公布的临床前数据显示,AZD5335对FRα低表达或高表达卵巢癌均体现出治疗潜力。目前,同靶点药物仅有Elahere(ImmunoGen公司)获FDA批准上市,用于治疗FRα高表达、晚期卵巢癌经治患者。
国际药讯
1.强生EGFR/c-Met双抗在美报sNDA。强生旗下杨森制药EGFR/c-Met双抗药物Rybrevant(amivantamab-vmjw)的补充上市申请获FDA受理,联合化疗(卡铂-培美曲塞)一线治疗EGFR外显子20插入突变、局部晚期或转移性非小细胞肺癌。在III期PAPILLON临床中,与单纯化疗相比,Rybrevant组合显著改善患者无进展生存期(PFS)。2021年5月,该新药已获FDA加速批准上市,用于铂类化疗后进展的EGFR外显子20插入突变的晚期或转移性NSCLC患者。
2.司美格鲁肽心衰Ⅲ期临床积极。诺和诺德每周一次2.4mg司美格鲁肽(Wegovy)治疗射血分数保留型心力衰竭(HFpEF)肥胖患者的Ⅲ期试验STEP HFpEF积极结果发表在《新英格兰医学杂志》上。与安慰剂相比,司美格鲁肽显著提高患者52周时KCCQ-CSS评分(16.6分vs8.7分);显著降低患者体重,降幅具显著性差异(13.3%vs2.6%)。Wegovy的安全性与既往研究一致。
3.默沙东PCSK9抑制剂上Ⅲ期临床。默沙东PCSK9抑制剂MK-0616用于治疗高胆固醇血症的Ⅲ期临床CORALreef首批受试者入组。在IIb期临床MK-0616-008(NCT05261126)中,MK-0616与安慰剂相比,4个剂量组(6mg、12mg、18mg和30mg)患者第8周时LDL-C水平较基线分别下降41.2%、55.7%、59.1%和60.9%,均具有统计学显著性;且临床中未出现与治疗相关的严重不良反应。
4.ITGB6靶向ADC启动肺癌Ⅲ期临床。Seagen公司靶向整合素β6(ITGB6)的ADC新药SGN-B6A在Clinicaltrials.gov网站上注册一项Ⅲ期临床,拟评估与多西他赛化疗头对头对照,用于治疗复发性非小细胞肺癌的有效性和安全性。该项试验预计2026年底初步完成。Seagen是拥有已上市ADC药物数最多的药企,目前已拥有3个自主研发的ADC药物获批上市,分别为靶向CD30的BrentuximabVedotin(Adcetris);靶向Nectin-4的Enfortumab Vedotin(Padcev );靶向TF的tisotumab vedotin (Tivdak)。
5.门诊用BCMA CAR-T获骨髓瘤孤儿药资格。FDA授予Nexcella公司针对门诊治疗开发的靶向BCMA的CAR-T疗法NXC-201孤儿药物资格,用于治疗多发性骨髓瘤(MM)。NXC-201优化的CAR结构设计,旨在提高其转导率,以及降低脱靶的发生率。在用于治疗MM和轻链淀粉样变性(AL)的Ⅰb/Ⅱ期NEXICART-1试验中,NXC-201的总缓解率达到90%;而且MM患者细胞因子释放综合征(CRS)中位发病天数为0;中位CRS持续时间为1天。
6.Keytruda+Lenvima组合HNSCC的III期研究失败。默沙东PD-1疗法Keytruda(帕博利珠单抗)联合卫材多受体酪氨酸激酶抑制剂(TKI)Lenvima(仑伐替尼)一线治疗肿瘤表达PD-L1、复发或转移性头颈部鳞状细胞癌(HNSCC)的III期LEAP-010试验未达到总生存期(OS)主要终点。与Keytruda+安慰剂相比,Keytruda+Lenvima组合方案未能改善患者OS指标;联合治疗的安全性与已知研究一致。两家公司已决定终止该项研究。
医药热点
1.NMPA完善药品附条件批准上市制度。8月25日,国家药监局发布《药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿)》。《征求意见稿》明确,药品获附条件批准上市后,需要继续完成确证性临床研究,完成时限原则上不超过4年;药品上市许可持有人自附条件批准上市起每12个月须向CDE书面报告上市后研究进展。此外,某药品获附条件批准上市后,原则上不再同意其他同机制、同靶点、同适应症的同类药品开展相似的以附条件上市为目标的临床试验申请。
2.曹华任福建省立医院党委书记。据福建省立医院微信公众号报道,8月25日,福建省立医院党委书记曹华主持召开党委理论学习中心组学习会,深入学习《中国共产党章程》和《关于新形势下党内政治生活的若干准则》,进一步统一思想、开好专题民主生活会。根据公开信息,曹华,主任医师,博士,教授,博士生导师。原为福建省妇幼保健院党委书记,兼任福建省儿童医院党委书记。
3.深圳市人民医院宝安医院开工。8月27日,深圳市人民医院宝安医院项目举行开工仪式。深圳市人民医院宝安医院位于宝安区沙井街道宝安大道,与蚝乡路交汇处西北侧,毗邻宝安国际机场、深圳国际会展中心,拟打造一流“国际化、智慧型、研究型”综合医院为项目建设目标。项目用地面积约11.14万平方米,按2000床综合医院规划建设,新建总建筑面积约46.6万平方米。
评审动态
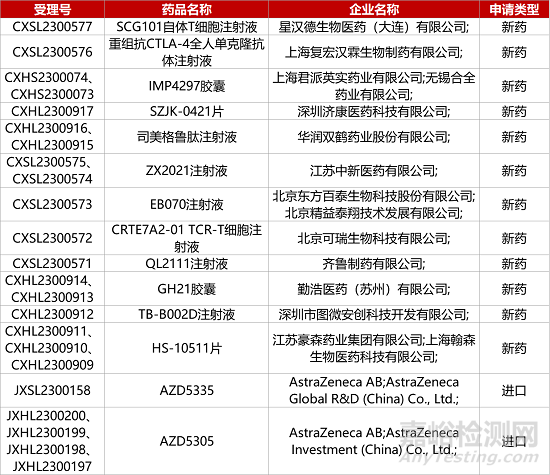
1. CDE新药受理情况(08月26日)
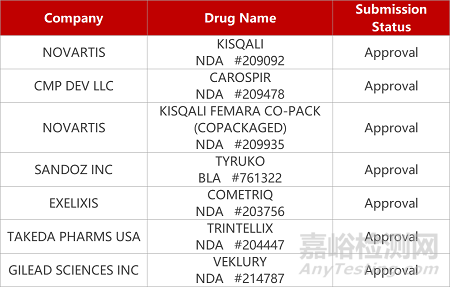
2. FDA新药获批情况(北美08月24日)