前言
原料药是药物的活性成分,化学类原料药通常是一个或多个化学单元操作制备而成,一个或多个化学单元操作即构成原料药生产工艺。工艺开发是将原料药产品化的一种技术过程,是产业化的桥梁,在医药产业中占有重要的地位。质量源于设计(Quality by Design),缩写为QbD。QbD概念应用于制药领域,最早是在2004年由美国FDA提出的[1-2],后来被纳入到ICH质量体系中并成为指导原则和指南。ICH 质量体系中Q8(药物研发)、Q9(质量风险管理)和Q10(药物质量系统)贯穿于小试研发、工艺开发和生产管理,是整个药物生命周期的指导法规。三者系统协调和配合共同促进药物的研发、生产和质量管理。
QbD强调“以终为始”的设计理念,即从目标产品的价值出发,对需求、功能和属性,直至产品的最终形态和使用条件进行反绎推理的过程。QbD理念的核心内容在于对产品和工艺的理解[3],即物料属性和控制参数对目标产品关键质量属性的影响,继而在此基础上开展设计空间和控制策略的研究。QbD理念应用于原料药合成工艺的开发中,可以使资源和要素以及目标得到更充分的整合与优化。本文将系统的介绍QbD理念的相关要素和研究思路,以及应用于原料药工艺开发的方法展开论述。
一、 QbD理念包含的内容
1.1 QbD定义
QbD(质量源于设计)根据ICH Q8的定义:是一种系统的研发方法,其以预先设定目标为起始,基于可靠的科学和质量风险管理,强调对目标产品和生产过程的理解及对工艺的控制。
1.2 QbD的关键要素
根据ICH的相关文件,QbD理念包括目标产品质量概况(QTPP)、关键质量属性(CQA)、关键物质属性(CMA)、关键工艺参数(CPP)、设计空间 (Design Space)、风险评估(Risk Assessment)和控制策略(Control Strategy)等关键要素[4-5]。详细见表1。
▲ 表1-QbD的关键要素
|
分类 |
内容 |
目的 |
|
目标产品质量概况(QTPP) |
概括了目标产品的主要质量属性,对原料药来说目标质量概况 如杂质(工艺杂质、遗传毒性杂质、元素杂质等)、含量、晶型、异构体、溶剂残留、粒径分布等属性。 |
总结了保证药品的安全性和有效性的基本质量属性。 |
|
风险评估(Risk Assessment) |
风险管理过程中针对影响目标产品质量的因素综合分析并评估关键信息,以支持风险决策的系统化过程。 |
分析评估系统性风险并支持风险决策。 |
|
关键质量属性(CQA) |
是指某种物理、化学、生物学或微生物学的性质属性,该属性应当有适当的限度、范围或分布,从而保证预期的产品质量。 |
确保对药品质量和安全性有影响的药品关键特性得以研究和控制。 |
|
关键物料属性(CMA) |
为达到目标产品质量,将对目标产品质量属性有明显影响的物理、化学和生物学物料性质或属性限定和控制在一定范围内,或在一定范围内分布。 |
确保对药品质量和安全性有影响的物料得以研究和控制。 |
|
关键工艺参数(CPP) |
指工艺步骤或单元操作的输入运行参数(速度、流速等)或状态变量(温度、压力等)能显著影响产出物料的关键质量属性时,该工艺参数就是关键工艺参数。 |
确保生产工艺能稳定生产出符合要求的产品。 |
|
设计空间(Design Space) |
与保证目标产品质量相关的输入变量(如物料属性)和工艺参数的多种优化组合,制定出输入变量(如物料属性)和工艺参数的合理空间。 |
设计空间用于保证工艺性能和产品质量的可靠性。 |
|
控制策略(Control Strategy) |
是指从目前产品属性和过程的理解,为达到目标预期而制定的控制方针、计划、方法等。 |
确保生产工艺性能和产品质量。 |
1.3 QbD系统研究思路
(1)预先设定目标
分析目标产品质量概况(QTPP),评估并确定目标产品关键质量属性(CQAs)。
(2)产品与工艺的理解
通过风险评估工艺过程中相关物料属性的变化和工艺参数的波动对目标产品的关键质量属性的影响,识别并确认关键物料属性(CMA)和关键工艺参数(CPP),并对其做进一步研究,以获得对工艺过程更深层次的理解。
(3)建立设计空间
设计空间是指研究评估小试、中试规模与预期商业化生产规模的工艺特性,建立合理的工艺参数和质量标准参数,在具体制定工艺参数及物料属性时,研究者应充分考虑预期的操作灵活性,并对规模扩大化生产过程中潜在的风险进行讨论。
(4)控制策略
控制策略源自对于现行产品属性和工艺特性的理解,为了用于保证目标产品的质量而对工艺性能和相关物料属性制定的有计划、有目的、针对性的控制手段。控制策略一般包括对原辅料的质量标准以及工艺过程的控制。
(5)产品生命周期管理与持续改进
工艺过程是持续优化和改进的过程,利用科技文献、先进知识等,结合风险评估(ICH Q9),通过对商业生产数据的综合评估,可以确定工艺改进的最佳方式。产品全生命周期中持续地改进和提高也是QbD理念的一部分[6]。
二、 QbD理念应用于原料药工艺开发
QbD理念是通过全面理解目标产品特性和生产过程建立的基于风险预防和控制的药物开发方法[7-8]。QbD理念应用于原料药生命周期的各环节,对于原料药研发、生产和监管提供了有效路径和方法,是遵守药品生产管理规范(cGMP)的内涵体现。
2.1 工艺设计阶段
(1)明确目标化合物(API)的质量概况(QTPP)
对于原料药来说,QTPP一般需要重点关注以下几点,见表2。
▲ 表2-原料药QTPP常见关注项和内容
|
分类 |
内容 |
|
有关物质 |
有机杂质:药典杂质、大于定量限的工艺杂质、基因毒性杂质、异构体杂质;无机杂质:是否引入元素杂质,重点关注1类、2A类元素杂质;溶剂残留:是否有1类、2A类溶剂残留等;其他:符合既定药典或者ICH要求。 |
|
含量 |
ICH对于原料药的要求一般98.0~102.0%,针对目标产品具体分析。 |
|
其他指标 |
外观、鉴别、重金属、水分、干燥失重、炽灼残渣等。 |
(2)评估并确定目标产品的关键质量属性(CQAs)
根据目标产品的质量概况QTPP,分析设定目标产品的关键质量属性(CQAs)。
关键质量属性(CQAs)设定依据通常如下:
①各国药典规定、ICH指导原则;
②前期研发同类产品的知识与经验;
③已上市同类产品厂家的质量控制信息,特别是原研产品质量信息;
④分析制剂产品的质量属性以及控制要求,评估对应的原料药关键质量属性(CQAs)。
原料药的质量属性与制剂的质量存在相关性,例如常见的的固体制剂,原料药的晶型、盐型、粒度等均影响片剂的溶出度,从而进一步影响药物的有效性。常见原料药质量属性与制剂质量的相关性见表3:
▲ 表3-原料药质量属性与制剂质量的相关性
|
原料药质量属性 |
与制剂质量的相关性 |
|
晶型、盐型、粒度 |
影响制剂溶出度,从而影响药物有效性 |
|
含量 |
影响制剂效力和含量均匀度 |
|
杂质:有关物质、遗传毒性杂质、残留溶剂、残留金属催化剂等 |
影响制剂杂质纯度、稳定性和安全性 |
|
鉴别 |
制剂鉴别 |
(3)设计合理路线
原料药工艺开发是在科学、合理的合成路线的基础上展开的,通常来说科学、合理的原料药合成路线必须至少具备以下特点[9]:
a)可行性-通过大量文献检索和理论分析,对目标化合物设计的合成路线必须从科学原理上可行。
b)可控性-合成工艺的反应条件和结果,批次间要具有重现性,要保证不同批次产品质量在合理范围内的稳定性,并符合拟定的质量控制要求。
c)合理性-工艺研究的目的是目标产品的产业化,工艺路线工业化对原材料、设备、反应条件等均有一定的要求。同时工业化需要评估环境污染、健康安全,如优选低毒性的溶剂、试剂,环境保护和劳动保护等。成本核算也是工业化的关键内容。
2.2 工艺确认阶段
(1)确定关键工艺参数(CPP)和关键物料属性(CMA)
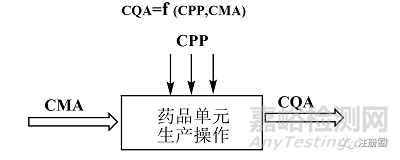
根据QbD关键要素中的定义,关键工艺参数(CPP)和关键物料属性(CMA)的波动或变化对目标产品的关键质量属性(CQAs)有显著影响。通常CMA、CPP与CQAs有如图1关系。
▲ 图1-CMA、CPP与CQAs关系示意图
由于工艺生产中通常是多个化学单元操作续贯生产,如果上一个单元操作的输出物料成为下一单元操作的输入物料时,此时输出物料的关键质量属性就可能变成下一单元操作时输入物料的关键物料属性。
(2)设计合理的工艺操控空间
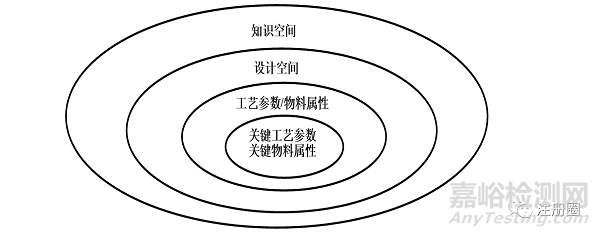
工艺设计空间(Design space)需研究评估小试、中试与预期商业化生产规模的工艺特性,并制定合理的研究方案和试验,制定出合理的工艺参数和质量标准参数。在具体制定工艺参数及物料属性时,研究者应充分考虑预期的操作灵活性,并对规模扩大化生产过程中潜在的风险进行讨论。通常关键物料属性(CMA)/关键工艺参数(CPP)、物料属性/工艺参数、设计空间和知识空间的关系如下[10]图2所示。
▲ 图2-关键物料属性(CMA)/关键工艺参数(CPP)、物料属性/工艺参数、设计空间和知识空间的关系图
采用风险控制工具识别影响产品CQAs的物料属性、关键工艺步骤及关键工艺参数(CPP),研究求证CQAs和工艺参数和物料属性的关联性,确定关键生产工艺参数(CPP)和关键物料属性(CMA)可能运行的变动范围。
2.3 工艺放大验证阶段
工艺从小试规模经过中试规模,再经过多批次的放大验证,到最终的商业化规模,伴随着生产规模的逐级放大,可能会伴随放大效应,通常需要通过不断调整工艺参数和控制范围,以达到保证目标产品质量的目的。
(1)评估反应规模相关的工艺参数
实验室到工厂放大过程中由于设备、传热、操作方式等变动,通常会伴随放大效应,与反应规模相关的常见因素和工艺参数/条件见下表4:
▲ 表4-与反应规模相关的常见因素和工艺参数/条件
|
分类 |
与反应规模相关的工艺参数 |
|
反应设备 |
设备介质、加料模式、温度控制范围等 |
|
反应过程 |
投料比例、加料速度、温度升降速率、搅拌速率等 |
|
后续处理 |
过滤粒度、真空度、干燥程度、热稳定性、引湿性 |
(2)验证关键工艺参数(CPP)、关键物料属性(CMA)控制范围
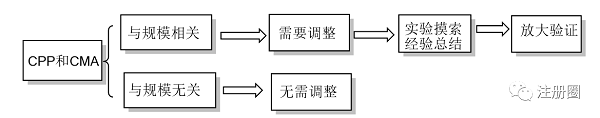
关键工艺参数(CPP)和关键物料属性(CMA),可以划分为与规模相关的参数/属性和与规模无关参数/属性两类[11]。与规模无关的参数/属性的控制范围无需调整,与规模相关的参数/属性,需要结合小试摸索、工艺特性和生产经验,调整并制定合适的控制范围,并进行至少3批次的放大验证。如图3所示。
▲ 图3-CPP和CMA与反应规模相关性工作流程图
三、 结语
原料药工艺开发的目的是通过科学合理的方法,建立能够持续生产出预期质量的商业生产工艺。QbD理念强调要制定目标,即在原料药工艺开发的早期环节,就强调质量控制需在可靠的科学和风险的管理基础上,对产品和工艺具有深刻的理解并加以控制, 是一个系统的药物开发方法。与之前的 QbP(Quality by Product)相比,进一步向前推进了质量控制的环节,使原料药合成工艺开发的整个过程更加充分、科学、有针对性,为原料药合成工艺的高效开发提供了有效的方法和理论指导。
参考文献
[1] MISHRA V, THAKUR S, PATIL A, et al.Quality by design (QbD) approaches in current pharmaceutical set-up [J].Expert Opin Drug Deliv, 2018, 15(8): 737-758.
[2] 刘理文.QbD在仿制药工程的应用路径设计[D].厦门,厦门大学硕士学位论文,2014.
[3] 李泮海,李进启,范秋英,冯巧巧.药品生产企业质量管理理念发展探讨[J].中国药物警戒,2011,8(02):93-96.
[4] 王明娟,胡晓茹,戴忠,马双成.新型的药品质量管理理念“质量源于设计”[J].中国新药杂志,2014,23(08):948-953.
[5] 缪仕伟.基于质量源于设计理念的CHO细胞无血清培养工艺开发与优化[D].上海,华东理工大学博士学位论文,2021.
[6] 李艳艳,中美仿制药的注册监管比较研究[D].浙江大学硕士学位论文,2018.
[7] 王笑笑,王君吉,赵源,何军,等.质量源于设计(QbD)理念在脂质体开发中的应用[J].中国医药工业杂志,2018,49(12):1635-1641.
[8] ARORA D, NANDA S.Quality by design driven development of resveratrol loaded ethosomal hydrogel for improved dermatological benefits via enhanced skin permeation and retention [J].Int J Pharm, 2019, 567: 118448.
[9] 李传润,彭成军,李家明,王虎,等.基于创新和学生能力培养的制药工艺学综合性实验改革—以苯妥英钠合成工艺优化为例[J].安徽中医药大学学报,2017,36(02):89-91.
[10]徐冰,史新元,乔延江,吴志生,等.中药制剂生产工艺设计空间的建立[J].中国中药杂志,2013,38(06):924-928.
[11]魏世峰,李维庸.药物创新制剂产业化及其综合优化技术[J].中国药学杂志,2019,54(21):1734-1738.