今日头条
珃诺BRD4蛋白小分子降解剂报IND。珃诺生物自研1类化药注射用RNK05047的临床试验申请获CDE受理。RNK05047是珃诺生物专有的蛋白降解平台CHAMP™开发的一款选择性靶向BRD4蛋白的小分子降解剂。去年8月,RNK05047已在美国开展的Ⅰ/Ⅱ期临床完成首例患者给药,这项临床试验将在晚期实体瘤和弥漫性大B细胞淋巴瘤(DLBCL)患者中评估RNK05047的安全性、耐受性、药代动力学和药效学。
国内药讯
1.共济失调新药在华启动Ⅲ期临床。Seelos Therapeutics公司可穿过血脑屏障的低分子量二糖SLS-005登记启动一项国际Ⅲ期临床(含中国),以评估其治疗成人脊髓小脑性共济失调3型(SCA3)的安全性和疗效。该项试验计划在全球入组245人,中国入组50人。试验的中国主要研究者由中南大学湘雅医院主任医师江泓教授担任。SLS-005曾获FDA和EMA授予多个孤儿药资格。
2.免疫/siRNA联合疗法乙肝Ⅱ期临床积极。腾盛博药与VBI Vaccine合作开发的免疫疗法BRII-179(VBI-2601),联合siRNA疗法BRII-835(VIR-2218)用于治疗慢性乙肝的Ⅱ期临床中期结果积极。联合治疗使患者HBsAg水平降低1.7~1.8 log10 IU/mL,其中有2例患者在40周时其HBsAg水平降低至能检测到的水平以下;组合疗法总体安全性良好。BRII-179的设计基于VBI的预防性乙肝病毒疫苗,该疫苗已获得FDA批准,商品名为PreHevbrio。
3.信达IGF-1R抗体上II期临床。信达生物宣布其重组抗胰岛素样生长因子1受体(IGF-1R)抗体注射液(IBI311)在治疗甲状腺相关眼病(TAO)受试者的II期临床完成首例患者给药。该项试验拟评估IBI311对甲状腺眼病(TED)受试者突眼的疗效;主要研究者由上海交通大学医学院附属第九人民医院的范先群院士和主任医师周慧芳共同担任。目前,Horizon公司替妥木单抗(Teprotumumab)是海外唯一获FDA批准用于TAO的IGF-1R单抗,国内尚未有针对TAO的药物获批。
4.绿叶长效IL-4Rα单抗上I期临床。绿叶制药旗下博安生物自研1类生物制品BA2101注射液在I期临床试验完成首例受试者给药。这是国内首个进入临床的IL-4Rα单抗,拟用于治疗特应性皮炎、哮喘、慢性鼻窦炎伴鼻息肉、结节性痒疹、慢性自发性荨麻疹等Th2型炎症引发的过敏性疾病。在临床前研究中,BA2101显示出较长的半衰期和更高的药物暴露量,预期给药周期为4周1次。
5.光谷中源干细胞疗法获批肝硬化临床。中源协和旗下武汉光谷中源开发的1类生物制品VUM02注射液获国家药监局临床默示许可。VUM02注射液(人脐带源间充质干细胞注射液)是中源协和公司自主研发的冷冻保存型干细胞制剂,是由健康胎儿脐带组织经体外分离、筛选、扩增后制备的人脐带源间充质干细胞(UC-MSC)悬液,临床拟用于治疗失代偿期肝硬化患者。
6.和铂B7H4/4-1BB双抗海外授权。和铂医药宣布与Cullinan Oncology就其临床早期B7H4/4-1BB双抗签订授权及合作协议,授予Cullinan Oncology在美国(包括哥伦比亚特区和波多黎各)开发及商业化HBM7008的独家许可权。根据协议,和铂医药将获得2500万美元预付款和最高达6亿美元里程碑付款,以及产品销售的分级特许使用权费。此外,Cullinan Oncology还有权在欧盟或澳大利亚进行人体临床研究并与和铂医药共享相关临床资料。
7.渤健退回诺诚健华BTK抑制剂全球权益。诺诚健华发布公告,宣布已收到渤健通知,决定为便利而终止双方就口服小分子布鲁顿酪氨酸激酶抑制剂(BTK)奥布替尼在多发性硬化症(MS)领域的全球独家权利以及除中国(包括香港、澳门和台湾)以外区域内的某些自身免疫性疾病领域的独家权利合作和许可协议,诺诚健华将重获许可协议项下授予的渤健所有全球权利。
国际药讯
1.英国NICE批准吉利德CAR-T治疗DLBCL。吉利德旗下Kite研制的CD19-CAR-T疗法Yescarta(axicabtagene ciloleucel)获英国国家健康与临床优化研究所 (NICE) 批准,纳入英国国家医疗服务体系(NHS),用于治疗弥漫性大B细胞淋巴瘤(DLBCL)。NICE独立评估委员会评估的数据显示,Yescarta用于三线治疗可使患者的中位总生存期达到28.5个月,患者的3年生存率高达45%。
2.Axcella公司EMM组合获批长新冠Ⅱb/Ⅲ期临床。Axcella公司基于内源性代谢调节剂(EMM)组合开发的多靶点口服药物AXA1125获FDA批准,即将在Ⅱb/Ⅲ期临床中评估用于治疗新冠病毒感染后长期症状(Long COVID)的潜力。EMM组合旨在通过同时作用于多个代谢通路,产生协同效应,从而治疗复杂疾病。此前,FDA已授予AXA1125快速通道资格,用于治疗伴肝纤维化非酒精性脂肪性肝炎(NASH)。
3.防病毒感染T细胞疗法Ⅱ期试验积极。AlloVir公司靶向免疫低下个体内常见六种病毒的T细胞疗法posoleucel,在治疗受BK病毒(BKV)感染的肾移植患者的Ⅱ期临床获积极结果。与安慰剂相比,posoleucel治疗组第24周时实现≥1-log的病毒量下降的患者比例更多(39%vs14%);posoleucel重复注射的耐受性良好。值得一提的是,该新药此前已获得FDA三个再生医学先进疗法认定。
4.创新眼科基因疗法早期临床积极。GenSight Biologics公司创新基因疗法GS030治疗视网膜色素变性(RP)的Ⅰ/Ⅱ期临床PIONEER结果积极。GS030包括一个基因疗法(GS030-DP)和一个可穿戴的光电视觉刺激设备(GS030-MD),通过单次玻璃体内注射,将编码光敏蛋白的基因导入视网膜神经节细胞,使它们对光有反应,并且不依赖于被色素性视网膜炎等疾病破坏的光感受器。接受治疗1年后的疗效数据显示,一些患者的视力从治疗前几乎无法感知光线到能够定位和计数物体,药物总体耐受性良好。
5.FIC光敏疗法NDA遭FDA拒绝。Soligenix公司潜在“first-in-class”光动力疗法SGX301用于皮肤T细胞淋巴瘤(CTCL)的新药申请(NDA)收到FDA的RTF(Refuse to file)信函。FDA认为该公司递交的NDA不完整,无法进行实质性审查。在关键III期FLASH(NCT02448381)研究中,SGX301治疗组8周时达到病灶减少>50%的患者比例显著高于安慰剂组(16%vs4%)。该新药此前已获FDA授予的孤儿药资格和快速通道资格。
6.强生退还NASH RNAi药物权利。在战略研发组合审查后,强生决定将ARO-PNPLA3(JNJ-75220795)全部权利交还给Arrowhead公司。ARO-PNPLA3是一款RNAi疗法,旨在降低含PATATIN样磷脂酶域蛋白3(PNPLA3)在肝脏表达,拟开发用于治疗非酒精性脂肪性肝炎(NASH)。来自I期研究 (NCT04844450) 初步数据显示,单次给药后I148M突变纯合子患者的肝脂肪剂量依赖性平均减少高达40%。
医药热点
1.辽宁省发文规范高校附属医院设置。近日,辽宁省人民政府发布《辽宁省加强普通高等医学教育临床教学工作若干措施的通知》。值得关注的是,关于规范高校附属医院设置方面,《通知》中指出,除国家区域医疗中心等符合跨省设立分院区有关规定的附属医院外,原则上取消跨省设立的附属医院。《通知》明确,各有关高校对跨省设立的附属医院予以摘牌,不得再新增跨省设立的附属医院。省、市属高校(包括民办高校)设立附属医院的数量一般不超过15家。
2.CDE连发3个指导原则。日前,CDE又连续发布3项指导原则,分别为《化学药品仿制药溶液型滴眼剂药学研究技术指导原则》、《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》,以及《药物真实世界研究设计与方案框架指导原则(试行)》。自发布之日起施行。
3.猴痘疫情仍构成“国际关注的突发公共卫生事件”。当地时间15日,世卫组织总干事谭德塞在每周例行发布会上表示,猴痘疫情继续构成“国际关注的突发公共卫生事件”。上周世卫组织举行了第四次猴痘疫情突发事件委员会会议,评估猴痘疫情。目前全球新增猴痘病例数量持续下降,但仍有三十多个国家继续上报猴痘病例。
评审动态
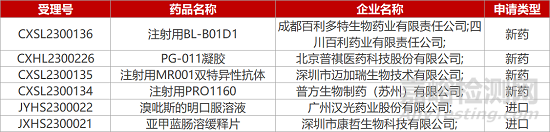
1. CDE新药受理情况(02月16日)
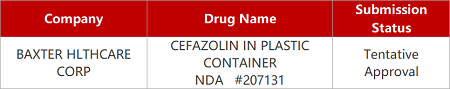
2. FDA新药获批情况(北美02月15日)