您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-01-20 20:31
编者按
核黄素,又称维生素B2,是一种人体必需的微量营养元素,且必须通过外源食物或营养补充剂获取,在重体力劳动、精神紧张、怀孕及青少年生长期,人体对核黄素的需求会增加。核黄素的合成方法主要有三种,包括全化学合成法、化学半合成法和微生物发酵法,而微生物发酵法是目前核黄素的最佳生产方法。
中国工程院院刊《Engineering》2022年第5期刊发中国农业科学院都市农业研究所甘人友副研究员研究团队的《微生物中核黄素合成的生物技术策略》一文。文章简述了核黄素在人体健康中的作用及其工业生产历史进程,详述了核黄素在细菌和真菌中的生物合成途径,并总结了利用现有的微生物发酵法高产核黄素的方法与策略,包括发酵条件的优化以及通过化学诱变和代谢工程技术构建核黄素高产菌株。文章指出,近年来,产核黄素微生物受到了越来越多的关注,其中,真菌(阿舒假囊酵母和棉阿舒囊霉)和细菌(枯草芽孢杆菌、大肠杆菌和乳酸菌)是理想的核黄素高产细胞工厂,因此,它们是增加发酵食品中核黄素含量或开发具有较高营养价值和人体健康益处的新型核黄素生物强化食品的优良候选菌株。利用精心挑选的菌株进行核黄素原位生产的理念,为开发面向不同或特定人群(如老年人、儿童、孕妇、运动员、素食者和青少年)的新型食品开辟了一条途径。
一、引言
核黄素(riboflavin, RF),又称维生素B2(图1),是一种具有高热稳定性(熔点为280 ℃)的水溶性B族维生素,其在酸性或中性溶液中对热稳定,短时间内加热不会被破坏,然而在碱性溶液中加热却极易被破坏。同时,核黄素也一种光敏性物质,暴露于短波辐射(< 400 nm)条件下会发生光降解。核黄素是人体必需的微量元素之一,具有广泛的生理功能,已被世界卫生组织(WHO)列为评估人体生长、发育和营养状况的六大指标之一。一个健康成年人的核黄素日平均需求量为0.3~1.8 mg,而当其日摄入量低于0.2~0.3 mg时,则会出现核黄素缺乏的症状。在某些特殊情况下,例如,重体力劳动、精神紧张、怀孕及青少年生长期,人体对核黄素的需求会增加。目前,核黄素缺乏症已引起了全球许多国家的关注。
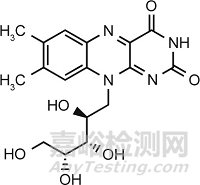
图1. 核黄素的化学结构。
核黄素是维持细胞正常功能不可或缺的营养物质。在被摄取后,核黄素在细胞内通过黄素激酶和黄素腺嘌呤二核苷酸(FAD)合成酶的作用,分别被转化为黄素单核苷酸(FMN)和FAD。这两种核黄素的主要生物活性衍生物随后作为电子载体,以及部分催化氧化还原反应的酶类(如琥珀酸脱氢酶、细胞色素c还原酶、葡萄糖氧化酶、醛氧化酶和黄嘌呤氧化酶)的必需辅助因子,参与一系列对人体新陈代谢至关重要的氧化还原反应。动物研究发现,核黄素能够影响铁离子的吸收和代谢,补充核黄素可以提高锌离子和铁离子的吸收。鉴于这两种微量金属元素在细胞增殖中的关键作用,核黄素也将间接地对生长起到积极的作用。反之,核黄素缺乏则会降低铁离子的吸收、储存和利用,从而导致人体生长迟缓。此外,核黄素缺乏或转运障碍可能引发白内障、神经系统疾病、心血管异常,甚至癌症。因此,保证有规律的核黄素日常饮食获取对于核黄素缺乏相关疾病的预防是很有必要的。
核黄素与大多数维生素一样,无法在人体内合成。因此,人体内的核黄素主要获取自日常饮食,也可能来源于人体肠道微生物菌群。核黄素以不同的含量天然存在于各种各样的食品中。与天然植物源性食品相比,动物源性食品是更好的核黄素来源,如内脏、牛奶和鸡蛋。此外,一些绿色蔬菜和豆类中也含有一定量的核黄素。虽然日常饮食中的核黄素易于吸收,但因其水溶性而无法在人体内大量储存,过量摄入的核黄素会随尿液和粪便排出体外。
二、核黄素的生产工艺
2012年全球核黄素年产销量达9000多吨,其中约1800 t用于医药和饮料行业,约7200 t用于动物饲料生产。随着功能性食品和动物饲料工业的发展,核黄素的需求量也日益增加。目前,核黄素的生产工艺主要有三种,包括全化学合成法、化学半合成法和微生物发酵法。其中微生物发酵法可分为两大类:传统的产核黄素微生物发酵和基因工程微生物发酵。
(一)全化学合成法
核黄素的全化学合成以D-核糖或D-葡萄糖为起始原料,通过6~9步化学反应合成核黄素,包括氧化、置换、转位、酸化、内酯化、还原、缩合、偶合和环化。显而易见,核黄素全化学合成是一个既繁复又耗时的过程(图2),而且生产成本高、环境污染严重。此外,通过该法制备的核黄素产品中通常含有难以消除且具有一定毒性的杂质。因此,全化学合成法逐渐被微生物发酵法所取代。
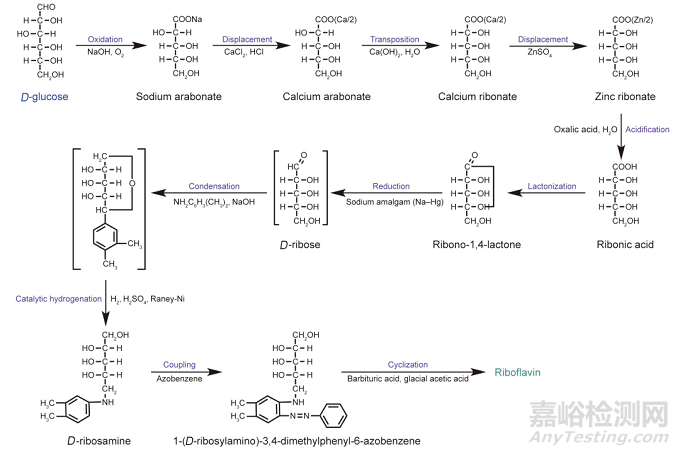
图2. 核黄素的全化学合成途径。
(二)化学半合成法
核黄素的化学半合成工艺采用微生物发酵与全化学合成相结合的方式,首先利用微生物发酵将D-葡萄糖转化为D-核糖,随后以发酵生产的D-核糖作为主要原料进行核黄素的化学合成。从D-葡萄糖到D-核糖的发酵生产能够简化核黄素的合成工艺流程,并降低生产成本,这也是全化学合成法与化学半合成法间的主要区别。然而,由于化学半合成法所用化学添加剂难以去除,导致其在最终产品中的残留量过高,因此不适合核黄素的大规模生产。
(三)微生物发酵法
自20世纪中叶起,微生物发酵法便已被应用于核黄素的商业生产,而最初使用的产核黄素微生物主要有三种,包括一种细菌[丙酮丁醇梭菌(Clostridium acetobutylicum)]和两种真菌[棉阿舒囊霉(Ashbya gossypii)和阿舒假囊酵母(Eremothecium ashbyii)]。然而,由于发酵周期长、产量低,早期的微生物发酵法无法与化学合成法相竞争,因此很难大规模商业化。之后,随着基因工程技术的发展,用于核黄素生产的基因工程菌被成功构建,如枯草芽孢杆菌(Bacillus subtilis)和产氨棒杆菌(Corynebacterium ammoniagenes)。这些细菌能够有效地将D-葡萄糖转化为核黄素,从而显著缩短生产周期,提高核黄素产量。因此,基因工程菌的应用最终促使微生物发酵生产核黄素的商业化变为现实。
总体而言,目前微生物发酵法生产核黄素具有生产周期短、原料简单、产率高、生产成本远低于全化学合成法和化学半合成法等优点。
三、核黄素的微生物合成
在真菌、酵母和真细菌等产核黄素微生物中,一分子核黄素的生物合成需要三分子磷酸鸟苷(GTP)和两分子5-磷酸核酮糖。如图3所示,作为核黄素生物合成的初始底物之一,GTP(1)在GTP环水解酶II(酶1)所催化的咪唑环开环水解反应中,从核糖基侧链处水解脱去无机焦磷酸基团,生成2,5-二氨基-6-核糖氨基-4(3H)-嘧啶酮-5'-磷酸(DARPP, 2)。DARPP(2)随后经还原和脱氨基两个连续反应被转化为5-氨基-6-核糖醇氨基-2,4(1H,3H)-嘧啶二酮-5'-磷酸(ArPP, 5),但这两个反应的先后顺序因微生物种类不同而异。在真菌中,DARPP(2)的核糖基侧链首先在还原酶的催化作用下被还原为核糖醇基侧链,产生的中间体2,5-二氨基-5-核糖醇氨基-4(3H)-嘧啶酮-5'-磷酸(DArPP, 4)在脱氨酶的作用下进一步脱去氨基,形成ArPP(5)。然而在真细菌中,DARPP(2)则首先在脱氨酶的作用下,脱氨基转化为中间产物5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮-5'-磷酸(ARPP, 3),后者继而在还原酶的作用下,经呋喃核糖基还原开环反应生成ArPP(5)。由此可见,DARPP在细菌和真菌中的还原和脱氨基反应顺序是相反的。在随后的反应中,ArPP(5)在一种非特异性的磷酸酶的作用下进一步脱去磷酸基团,被转化为5-氨基-6-核糖醇氨基-2,4(1H,3H)-嘧啶二酮(ArP, 6),但该磷酸酶至今尚未明确。近来研究发现,在枯草芽孢杆菌、大肠杆菌和多形拟杆菌(Bacteroides thetaiotaomicron)等菌株中,卤代酸脱卤酶(haloacid dehalogenase, HAD)超家族蛋白可以催化ArPP(5)的去磷酸化,与酶4的作用相符。另一方面,5-磷酸核酮糖(7)作为核黄素生物合成的另一初始底物,首先在磷酸丁酮合成酶(酶5)的催化作用下,经分子骨架重排形成3,4-二羟基-2-丁酮-4-磷酸(3,4-dihydroxy-2-butanone-4-phosphate, DHBP, 8)。随后,在二氧四氢喋啶合酶(或核黄素合酶β-亚基,酶6)的作用下,DHBP与Arp(6)发生缩合反应,生成6,7-二甲基-8-核糖醇基-二氧四氢喋啶(6,7-dimethyl-8-ribityllumazine, DMRL, 9)。作为核黄素合成的直接前体物质,DMRL最终在核黄素合酶(或核黄素合酶α-亚基,酶7)的作用下,经特殊的歧化反应被转化为核黄素(10)和ArPP(5)。其中,产物ArPP(5)可再次用于另一核黄素分子的生物合成。
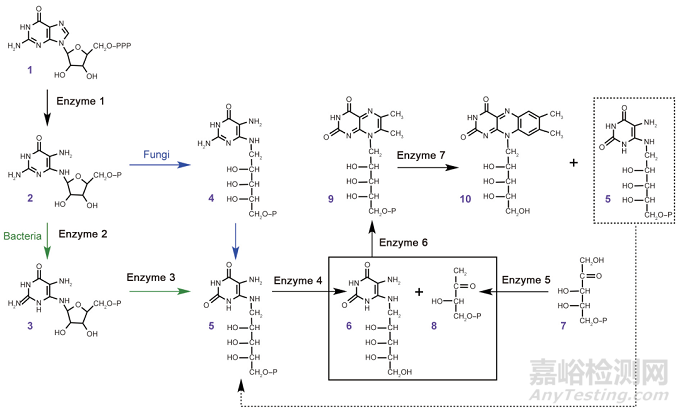
图3. 核黄素的生物合成途径。化合物1是三磷酸鸟苷(GTP);2是2,5-二氨基-6-核糖氨基-4(3H)-嘧啶酮-5'-磷酸(DARPP);3是5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮-5'-磷酸(ARPP);4是2,5-二氨基-5-核糖醇氨基-4(3H)-嘧啶酮-5'-磷酸(DArPP);5是5-氨基-6-核糖醇氨基-2,4(1H,3H)-嘧啶二酮-5'-磷酸(ArPP);6是5-氨基-6-核糖醇氨基-2,4(1H,3H)-嘧啶二酮(ArP);7是5-磷酸核酮糖;8是3,4-二羟基-2-丁酮-4-磷酸盐(DHBP);9是6,7-二甲基-8-核糖醇基-二氧四氢喋啶(DMRL);10是核黄素。酶 1:GTP环水解酶II;酶 2/酶 3:双功能核黄素特异性嘧啶脱氨酶/还原酶;酶 4:非特异性磷酸酶;酶 5:DHBP合成酶;酶 6:二氧四氢喋啶合酶或核黄素合酶β-亚基;酶 7:核黄素合酶或核黄素合酶α-亚基。
核黄素的微生物发酵合成通常使用真菌和细菌。目前的研究主要集中于两种类酵母真菌(阿舒假囊酵母和棉阿舒囊霉)以及三种细菌(枯草芽孢杆菌、大肠杆菌和乳酸菌)的应用。对于阿舒假囊酵母和棉阿舒囊霉这两种真菌,可以通过化学诱变和基因工程的手段实现定向进化,从而调节核黄素的生物合成,实现核黄素产量的提高。然而,改造后的真菌通常发酵周期较长、发酵液黏度高,且需要在含有多种成分的培养基中培养。这些不利因素将增加后期核黄素分离纯化的难度,同时提高了生产成本。此外,培养基中还应不断补充外源物质(不饱和脂肪酸),以提高真菌的生物合成能力。相比之下,使用细菌的优势更为明显,例如,发酵周期短、培养基成分简单,以及可用于细菌的基因工程技术已较为完善。
(一)真菌
1. 阿舒假囊酵母
阿舒假囊酵母(Eremothecium ashbyii, E. ashbyii)是目前用于工业发酵生产核黄素的主要菌株之一,因此其发酵特性也得到了较为全面而详细的研究。Kalingan和Krishnan证明了不同碳源和氮源及其初始浓度对E. ashbyii NRRL 1363核黄素产量的影响。在此基础上,一系列针对核黄素工业生产工艺优化的研究相继开展。Kolonne等报道了pH值对阿舒假囊酵母的胞外核黄素产量的影响。结果表明,在pH值为4.5和5.5时其胞外核黄素产量较高,而在pH值为3.5和8.5时几乎没有核黄素合成。Pujari和Chandra通过紫外诱变的方式获得了一株核黄素高产突变菌株 E. ashbyii DT1,但该菌株产量低、遗传特性不稳定,限制了其核黄素产量的进一步提升。根据微生物的代谢调控机制,使用具有核黄素及其代谢物类似物抗性的突变菌株,可以降低核黄素生物合成途径中某些关键酶的反馈抑制,进而可能提高核黄素的积累量。然而,阿舒假囊酵母不能在无机盐培养基中生长,同时也很难找到适合其生长的合成培养基。因此,找到适宜的合成培养基,将提高稳定的核黄素高产阿舒假囊酵母突变菌株的筛选成功率,这些突变菌株的进一步应用将提高核黄素的产量。
2. 无名假丝酵母
作为一种天然的核黄素高产菌株,无名假丝酵母(Candida famata,C. famata, C. flareri)曾被用于核黄素的工业生产。虽然近年来该酵母已不再被应用于工业化生产,但其在基因工程领域的研究仍在继续且取得了不少进展。这些研究进展表明,无名假丝酵母具有改造为新型核黄素高产基因工程菌的潜力。
Yatsyshyn等以TEF1为启动子构建了一个携带有汉逊德巴利酵母(Debaryomyces hansenii)FAD1基因(编码FAD合成酶)和FMN1基因(编码核黄素激酶)的质粒pTFMN1-FAD1,并将该质粒转入到FMN1基因过表达的重组无名假丝酵母T-OP 13-76之中。在所获得的重组菌株中,一株命名为C. famata T-FD-FM27的菌株,在最佳条件下分批发酵40 h后生成了451 mg∙L-1的黄素腺嘌呤二核苷酸(FAD)。这是关于FAD高产酵母菌株构建的首次报道。
在另一项研究中,Dmytruk等以非回复C. famata AF-4菌株为出发菌种,构建了共同过表达SEF1、RIB1和RIB7基因的高产核黄素菌株。利用7 L的实验室生物反应器进行补料分批发酵实验,该菌株在优化后的培养基中的核黄素产量达到了16.4 g∙L-1,是目前已知的核黄素最高产菌株之一。此外,当将修饰后的PRS3和ADE4基因(分别编码PRPP合成酶和PRPP酰胺转移酶,均来源于汉逊德巴利酵母)导入到上述构建的菌株后,其核黄素产量增加了两倍。
3. 棉阿舒囊霉
丝状半子囊菌棉阿舒囊霉最初是从染病的棉花植株(Gossypium sp.)中分离出来的,继而又被发现是一种天然的核黄素高产菌种。在营养应激条件下,这种真菌的菌丝体会分化形成孢子囊,而孢子在孢子囊内形成的同时,核黄素被合成,其作用可能是保护透明且对紫外线敏感的孢子。经过数十年的菌种改良,1990年基于棉阿舒囊霉(Ashbya gossypii, A. gossypii)的核黄素生物技术合成方法的建立,使核黄素的单位生产率达到了较高的水平,并取代了先前的核黄素多级化学反应合成。棉阿舒囊霉具有天然的核黄素合成能力,其应用于核黄素工业生产已有20多年的历史。同时,棉阿舒囊霉也具有重要的科学价值,不仅在生物技术领域具有广阔的潜在应用前景,而且被广泛地用作真菌发育和进化生物学研究的模式菌种。近年来,棉阿舒囊霉在工业应用和基础研究方面均取得了丰硕的成果,促进了用于高端基因工程的分子和生物信息学工具的发展,充分发挥了它们的生物技术应用潜力。
除了核黄素生产之外,近年来对棉阿舒囊霉在其他生物技术应用方面的研究也取得了重大进展。尽管如此,基于棉阿舒囊霉的核黄素生产工艺优化,以及核黄素高产棉阿舒囊霉菌株的开发,仍是众多研究人员的主要目标,且当前的研究多集中于分子水平。Schwechheimer等利用13C同位素标记技术对产核黄素真菌A. gossypii B2的碳通量进行了解析。该研究以植物油为原料,采用复杂的工业发酵工艺生产核黄素。根据13C标记数据,甲酸和丝氨酸为一碳供体,可对核黄素的生物合成起到积极影响,而甘氨酸则为唯一的核黄素嘧啶环二碳供体。此外,核黄素合成后期内源甲酸的积累可以克服初期细胞内一碳代谢途径存在的严重瓶颈问题,且少量、分批补充甲酸和丝氨酸可以增强两者在细胞内的可利用度,使核黄素产量增加45%。随后,Schwechheimer等首次成功实现了A. gossypii B2菌种在生长阶段和核黄素生物合成阶段的碳通量定量计算。结果表明,酵母提取物作为常用的工业培养基成分,是菌株生长过程中的主要碳源,对菌株的生长具有显著影响。然而,菜籽油则为核黄素合成过程中的主要碳源,因此对核黄素生产的影响最大。这些结果突出了碳源对核黄素生产的重要性,需慎重选择。该研究为A. gossypii B2菌株在复杂的工业发酵条件下的物质代谢带来了一些全新的认识,对进一步的菌种改良和工艺优化具有重要指导意义。Jeong等利用13C同位素标记技术对野生棉阿舒囊霉(ATCC 10895)及其核黄素高产突变菌株(W122032)的代谢通量进行了分析,并在此基础上进一步分析了两个菌种在中心碳代谢途径上的差异,以期解析棉阿舒囊霉的核黄素过量合成途径。代谢通量分析结果显示,突变菌株W122032的磷酸戊糖途径(pentose phosphate pathway, PPP)-磷酸戊糖合成的代谢通量比野生株高9%,其嘌呤合成途径(purine synthetic pathway, PSP)-核黄素合成的代谢通量(1.6%)比野生株(0.1%)高16倍。这些结果表明,棉阿舒囊霉突变菌株中由PPP和PSP代谢通量的变化所引起的GTP代谢通量的增加,是其核黄素产量提高的主要原因,这也同时说明增强与PPP和PSP相关基因的表达是提高核黄素产量的一种方案。Silva等以A. gossypii ATCC 10895为出发菌株,利用基因工程技术构建了一株尿苷/尿嘧啶营养缺陷型菌株A. gossypii Agura3,并研究了其嘧啶从头生物合成途径(de novo pyrimidine biosynthetic pathway)阻断所带来的影响。结果表明,该菌株在常规固体天然培养基上的核黄素产量得到了提高,且尿苷/尿嘧啶的外源添加会抑制核黄素的生成。此外,高浓度的尿嘧啶抑制了该菌株及其出发菌株(A.gossypii ATCC10895)的生长,而过量的尿苷则加速了它们的生长。该研究首次通过实验探明了棉阿舒囊霉嘧啶生物合成途径中相关基因的改变对其核黄素产量的影响。
作为天然核黄素高产菌种,棉阿舒囊霉菌必须确保较高水平的鸟嘌呤核苷酸途径(guanine nucleotide pathway)代谢通量,以提高核黄素限制性前体物质GTP的生物可利用度。因此,该真菌核黄素产量的进一步提高需要对其GTP生物合成途径中关键酶的特性有充分的认识。在嘌呤生物合成途径中,肌苷酸(inosine-5'-monophosphate, IMP)是腺苷酸(AMP)和鸟苷酸(GMP)的共同前体物质,其在肌苷酸脱氢酶(inosine-5'-monophosphate dehydrogenase, IMPDH)的催化作用下被氧化为黄苷酸(xanthosine-5'-monophosphate, XMP),该步反应是一个限速反应。经过一系列连续反应后,XMP最终被转换成GTP。由此可见,IMPDH是嘌呤生物合成途径的一个重要的代谢瓶颈。然而,从代谢工程技术角度来看,这种酶的基因改造可操作性高。Buey等对棉阿舒囊霉菌中的IMPDH进行了详细的功能分析和结构表征。结果表明,当A.gossypii ATCC 10895菌株的IMPDH基因过表达时,鸟嘌呤生物合成途径的代谢通量增加,最终使该菌株的核黄素产量提高了40%。这项研究极大促进了旨在提高棉阿舒囊霉核黄素产量的代谢工程工具的开发。Ledesma-Amaro等分析了每个rib基因对棉阿舒囊霉核黄素产量的影响,发现当rib基因的转录水平和底物GTP的生物可利用度较低时,棉阿舒囊霉的核黄素合成会受到阻碍;而当rib基因(最多5个)共同过表达时,会显著提高该菌的核黄素产量。研究还发现,编码腺苷酸琥珀酸合成酶(adenylosuccinate synthase)并调控嘌呤途径的腺苷酸(adenosine-5'-monophosphate, AMP)分支第一步反应的ADE12基因,其失活或低表达时对核黄素合成具有积极影响。此外,Ledesma-Amaro等还利用代谢工程技术构建了一株过表达所有rib基因并低表达ADE12基因的棉阿舒囊霉菌株A330,该菌株的核黄素产量高达523 mg·L-1,是野生菌株(A.gossypii ATCC 10895)的5.4倍。该研究为工业核黄素产量的增加提供了一种可控且可规模化的策略。
Park等利用差异诱变技术获得了一株核黄素高产棉阿舒囊霉突变菌株(W122032)。使用优化后的培养基,该菌株在3L发酵罐中的核黄素产量为13.7 g·L-1,比野生菌株(A.gossypii ATTC 10895)的产量增加了9倍。蛋白质组和DNA微阵列分析结果显示,参与嘌呤和核黄素生物合成途径的基因上调,与碳源同化、产能和糖酵解相关途径的基因下调。这些结果表明,突变菌株核黄素产量的提升与碳代谢通量从β-氧化向核黄素生物合成途径的转移有关。
(二)细菌
核黄素在革兰氏阳性菌和革兰氏阴性菌中的生物合成已有较为详细的研究,尤其是在枯草芽孢杆菌和大肠杆菌中。在产核黄素细菌中,核黄素的合成由编码五个基因(ribGBAHT)的核黄素操纵子(rib操纵子)所控制(图4)。然而,rib操纵子上前四个编码核黄素合成酶的结构基因的顺序与核黄素生物合成途径中的酶促反应顺序(图3)不同。RibA是第三个rib基因,编码一种具有GTP环水解酶II和3,4-二羟基磷酸丁酮合成酶活性的双功能酶。该酶是一种限速酶,其GTP环水解酶II活性可催化核黄素合成的第一步酶促反应。RibG是第一个rib基因,编码另一种双功能酶,其核黄素特异性脱氨酶/还原酶活性可依次催化第二和第三步酶促反应。RibH是最后一个rib基因,编码二氧四氢喋啶合成酶(或核黄素合成酶的β亚基),其催化倒数第二步酶促反应。作为rib操纵子的第二个基因,ribB基因编码核黄素合成酶的α亚基,催化最后一步酶促反应。此外,rib操纵子还编码一个功能尚未明确的基因ribT。该基因被注释编码了一个假定的N-乙酰转移酶,且研究表明这个酶的失活虽不会导致核黄素营养缺陷现象,但会显著降低核黄素的产量。最新的结构研究表明,枯草芽孢杆菌的ribT基因所编码的酶属于GCN5(general control nonderepressible-5)相关N-乙酰转移酶(GCN5-related N-acetyltransferase, GNAT)超家族成员,该超家族的酶能够催化多种底物的酰基化反应,即将乙酰辅酶A的乙酰基转移到底物上。
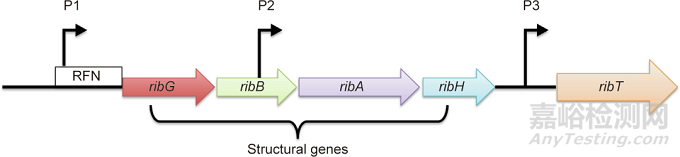
图4. 细菌rib操纵子的结构。结构基因ribGBAH编码代谢相关蛋白,转运基因ribT编码转运相关蛋白。细箭头表示启动子P1、P2和P3的转录方向。此处,RFN指代RFN element,即RFN元件。
ribC、ribR和ribO是枯草芽孢杆菌rib操纵子上游存在的三个调控区域,被认为是核黄素生物合成的假定抑制子,因为每个区域发生突变都会导致核黄素的过量合成。其中,ribC和ribR分别编码一种双功能黄素激酶/FAD合成酶和单功能黄素激酶,这两种酶可将核黄素顺序转化为FMN和FAD。RibO是位于ribP1启动子和ribG基因之间的一个非编码区,其转录产物可以折叠形成一个保守的RNA二级结构,称为黄素单核苷酸核糖开关(FMN riboswitch)。黄素与FMN核糖开关的相互作用在rib操纵子的转录调控中起着关键作用。在解离状态下,FMN因浓度过低而不足以与FMN核糖开关结合形成抗-反终止子结构,从而形成反终止子,以确保后续基因序列的转录;然而,在抑制状态下,FMN与FMN核糖开关结合,形成转录终止子从而使转录终止。
此外,如图4所示,rib操纵子还含有三个启动子,包括一个一级启动子P1(ribP1)和两个二级启动子P2和P3(ribP2和ribP3)。ribP1启动子位于第一结构基因ribG的上游,ribP2启动子位于ribB的编码区内,而ribP3启动子位于ribH和ribT两个基因之间。四个rib基因(ribGBAH)的转录主要由ribP1和位于rib操纵子5'端的调控区控制,最后两个基因ribA和ribH则由ribP2启动子和RFN调控区控制转录。
1. 丙酮丁醇梭菌
丙酮丁醇梭菌(Clostridium acetobutylicum, C. acetobutylicum)是一种严格厌氧的革兰氏阳性菌,一个多世纪以来被广泛用于生物丁醇的发酵生产。这种细菌通常以6∶3∶1的平均质量比合成丁醇、丙酮和乙醇。自20世纪40年代起,除了丁醇高产菌株角色之外,该细菌作为天然核黄素生产菌种的角色也被认可,因为在其丁醇-丙酮-乙醇(butanol-acetone-ethanol, ABE)发酵过程中发现了核黄素的存在。从经济角度来看,如果核黄素作为第二产物或高附加值副产物的工业产量能够达到0.5~1.0 g·L-1,ABE发酵工艺的经济价值则将显著提高。然而,经过几十年的研究,丙酮丁醇梭菌ABE发酵过程中的核黄素产量仍提高不足。最近,Zhao等研究发现,在以木糖作为碳源的细菌生长培养基中外源添加乙酸钠(NaAc),对C. acetobutylicum ATCC 824菌株ABE发酵过程中的核黄素合成具有较强的促进作用。在添加60 mol·L-1 NaAc后,核黄素的生物合成率(ribA通量率)几乎是对照组的10倍,而核黄素的最终浓度也从最初的无法检测增加到0.2 g·L-1(0.53 mmol·L-1)。该研究为基于丙酮丁醇梭菌的生物丁醇和核黄素发酵联产提供了一种新的策略,该策略的实现将提高ABE发酵工艺的商业价值。
2. 大肠杆菌
作为基础生物学研究常用的工具菌株,革兰氏阴性菌大肠杆菌(Escherichia coli, E. coli)的基因组已得到很好的表征,且多种适合其基因编辑的成熟的分子工具也已构建。此外,大肠杆菌因其诸多优势,长期以来一直被用作各种物质高效合成的常用宿主,如氨基酸、生物燃料以及散装化学品。例如,大肠杆菌在最佳培养条件下的生长迅速,倍增时间仅为20 min,且其在由廉价原料构成的培养基中也很容易生长。基于这些极具吸引力的优势,大肠杆菌也被认为是生产核黄素的潜在高效宿主,然而野生型大肠杆菌在自然条件下无法积累核黄素。因此,一系列针对产核黄素大肠杆菌菌种构建的研究相继展开,并进行了大量的代谢工程策略的探索工作。
目前,几乎所有的实验室大肠杆菌菌株均源自于非致病性的K-12或B菌株。尽管这两种菌株之间在细胞代谢和生理上存在许多差异,但比较基因组分析结果显示,它们是非常相似且密切相关的。相比于K-12菌株,B菌株在基本培养基中的生长速度更快,重组蛋白的表达水平更高,且乙酸的产量更低。E. coli BL21 (DE3)是一种特殊的工程B菌株,在科学研究和工业生产中的应用最为广泛。阐明K-12和B菌株在调节机制和代谢方面的差异,将有助于提高它们在代谢工程中的利用率。
Wang等首次证明了E. coli BL21 (DE3)在正常培养条件下可以积累核黄素。核黄素生物合成相关酶的序列分析发现,与K-12 MG1655菌株相比,BL21 (DE3)菌株在ribF基因的第115位氨基酸残基上发生了单一点突变,这个His115Leu突变引起了ribF基因编码的双功能核黄素激酶/FMN腺苷酸转移酶的活性不足,可能是导致核黄素在该菌株中积累的原因。然而,进一步的定量PCR分析显示,所有核黄素生物合成基因均上调,表明过量的核黄素积累也可能是由某个能上调所有核黄素合成基因的调控机制引起的,而且这个原因似乎更为合理。该研究认为E. coli BL21 (DE3)或许也可应用于核黄素的生产。
已有研究表明,枯草芽孢杆菌嘌呤生物合成途径中的一些关键基因的修饰可以增加核黄素前体物质的供应,从而促进核黄素的生物合成。近年来,类似的研究工作也同样在大肠杆菌中展开。Xu等首先以野生型E. coli MG1655为出发菌种,构建了一株产核黄素的菌株E. coli RF01S,并随后对该重组菌种的ribB基因和嘌呤途径的5个关键基因(包括ndk、gmk、purA、purF和prs)分别进行了修饰,最终得到了能够同时过表达所有6个基因的菌株RF18S。该菌株在摇瓶发酵中的核黄素产量为387.6 mg·L-1,核黄素转化率为44.8 mg·g-1葡萄糖。与RF01S相比,RF18S的核黄素产量和转化率分别提高了72.2%和55.6%。此研究证明,利用合理的代谢工程技术同时对DHBP合成酶和GTP生物合成途径进行修饰,是显著提高大肠杆菌核黄素产量的有效策略。
Lin等利用代谢工程技术构建了一个携带有核黄素操纵子(由诱导型trc启动子调控)的质粒p20C-EC10,并将其转化入野生型E. coli MG1655中,得到的重组菌株RF01S可积累229.1 mg∙L-1的核黄素。随后,将RF01S菌株的pgi(编码葡萄糖-6-磷酸异构酶)、edd(编码磷酸葡萄糖酸脱水酶)和eda(编码多功能2-酮-3-脱氧葡萄糖酸-6-磷酸醛缩酶/2-酮-4-羟基戊二酸醛缩酶/草酰乙酸脱羧酶)基因逐步删除,并在其acs基因(编码乙酰辅酶a合成酶)的上游插入trc启动子,得到重组菌株RF05S,其核黄素产量可达585 mg∙L-1。最后,通过调节RF05S菌株中ribF基因(编码一种双功能核黄素激酶/FMN腺苷酸转移酶)的表达,以减少核黄素向FMN的转化,由此构建的菌株RF05S-M40在37 ℃条件下于LB(Luria-Bertani)培养基中可产生1036 mg∙L-1的核黄素。优化发酵条件后,RF05S-M40菌株在最佳条件下通过摇瓶发酵的核黄素产量达到了2703 mg∙L-1,比RF01S菌株的核黄素产量高了近12倍,核黄素转化率为136 mg∙g-1葡萄糖。在摇瓶发酵情况下,E. coli RF05S-M40的核黄素产量是所有已报道的产核黄素菌株中最高的。随后,Lin等所在的实验室同样以野生型E. coli MG1655为出发菌种,通过pfka(编码6-磷酸葡萄糖内酯酶I)、edd和eda基因敲除的方式提高磷酸戊糖(pentose phosphate, PP)途径的碳代谢通量,由此成功构建了另一种新型产核黄素大肠杆菌菌株LS02T。该菌株所携带的核黄素操纵子表达质粒pLS01也是在该研究过程中新构建的,其具有比上述研究中所构建的质粒p20C-EC10更好的稳定性。通过摇瓶发酵,该菌株在含有10 g∙L-1葡萄糖的MSY培养基中可产核黄素667 mg∙L-1;而在补料分批发酵中,该菌株的核黄素产量达10.4 g∙L-1,转化率为56.8 mg∙g-1葡萄糖。该研究首次报道了一种在补料分批发酵中核黄素产量超过10 g∙L-1的大肠杆菌工程菌株。上述两项研究结果表明,大肠杆菌确实是一种潜在的、高效的核黄素生产菌种。
3. 枯草芽孢杆菌
枯草芽孢杆菌(Bacillus subtilis, B. subtilis)是一种自然普遍存在的细菌,是所有革兰氏阳性菌中研究最为清楚的菌种之一。它已被欧洲食品安全局(European Food Safety Authority, EFSA)授予了安全资格认定(qualified presumption of safety, QPS),可用于生产动物饲料和人类食品及补充剂,如维生素K2,是安全且稳定的生产菌种。此外,基于核黄素生物合成相关酶在生化、生理和遗传水平上的详细研究,枯草芽孢杆菌也被成功改造为核黄素生产的细胞工厂。因此,枯草芽孢杆菌成为利用细菌进行核黄素商业化生产的首选菌种,也是目前最重要的菌种。
在过去的20年中,科研人员借助于代谢工程技术进行了大量的枯草芽孢杆菌核黄素产量提高的研究。这些研究大多集中在前体物质的供应和关键酶的表达调控上,这两点也被认为是核黄素合成的主要限制因素。
5-磷酸核酮糖(ribulose-5-phosphate, Ru5P)是核黄素的初始前体物质,合成于磷酸戊糖途径的氧化分支,其合成反应由两个连续的NADP+-依赖型蛋白酶所催化,即葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PD)和6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase, 6GPD)。然而,这两种酶的活性会被Ru5P以及其他几种细胞内代谢物如NADPH和1,6-二磷酸果糖(fructose-1,6-biphosphate, FBP)所抑制。细胞内代谢物的这种变构抑制可导致核黄素合成所需的前体物质供应不足。Wang等克隆了谷氨酸棒杆菌Corynebacterium glutamicum ATCC13032的zwf(编码G6PD)和gnd(编码6GPD)基因,并利用定点突变成功消除了这两个基因的反馈抑制,以期通过基因改造提高Ru5P的利用率。随后,这两个突变基被导入到B. subtilis RH33菌株进行单独表达或共同表达,以量化它们的表达对核黄素合成的影响。结果表明,与亲本菌株RH33相比,工程菌株中核黄素生物合成途径中的代谢产物含量显著增加,如Ru5P(增加46%)、DMRL、氨基咪唑以及胞内核黄素。在摇瓶发酵中,工程菌株B. subtilis SVZ(zwf基因单独表达)、工程菌株B. subtilis SVG(gnd基因单独表达)和工程菌株B. subtilis VGZ(zwf和gnd基因共同表达)的核黄素产量分别增加18%、22%和31%。在进一步的补料分批发酵中,B. subtilis VGZ的核黄素产量平均提高了39%。该研究证明,前体物质供应是枯草芽孢杆菌核黄素合成的主要限制因素,而利用代谢工程技术将碳代谢通量重定向至磷酸戊糖途径是提高核黄素产量的有效策略。
为了增加核黄素生物合成途径的碳代谢通量水平,Shi等对产核黄素B. subtilis BS77菌株的rib操纵子进行了基因改造,包括ribA基因的过表达,原有启动子ribP1的取代(替换为来自于B. subtilis 168菌株的强启动子P43),以及RFN调控区ribO基因的敲除。其中,ribA基因过表达的菌株BS89具有最高的核黄素产量(506 mg∙L-1),是菌株BS77(210 mg∙L-1)的1.4倍。在此基础上,一个连续优化方案随后开展,以解除BS89菌株rib操纵子嘌呤生物合成途径的反馈调控,包括:①敲除嘌呤操纵子(pur operon)的阻遏蛋白(即PurR,由purR基因编码)基因及包含有鸟嘌呤感应核糖开关的5'端非翻译区(5'-untranslated region, 5'-UTR),以消除反馈抑制;②通过定点突变消除PRPP转氨酶(由purF基因编码)的产物反馈抑制。这些基因改造成功实现了嘌呤生物合成途径代谢通量的增加,从而使构建的基因工程菌BS110(发生purF-VQW突变)在摇瓶发酵条件下,获得最高的核黄素产量(827 mg∙L-1)。该研究表明,通过合理地解除嘌呤生物合成途径的反馈调控,消除转录抑制和产物反馈抑制,是提高枯草芽孢杆菌代谢产物产量的一个可行策略。
对于合理的、以目标代谢物产量的提高为目的的代谢工程策略的制定来说,对中心碳代谢途径的深入认识是至关重要的。糖异生(gluconeogenesis, GNG)是指将非糖物质转化为葡萄糖的生物过程,为中心碳代谢最重要的途径之一。糖异生途径的调节已成功地应用于谷氨酸棒杆菌碳代谢通量向磷酸戊糖(PP)途径的重定向。此外,前人研究表明,糖异生途径中关键酶反馈调控的解除,也是进一步提高核黄素产量的一种可行策略。
因此,Wang等以B. subtilis RH33为出发菌株,通过过表达该菌株中三个关键的糖异生基因,包括gapB(编码NADPH依赖型的3-磷酸甘油醛脱氢酶)、pckA(编码磷酸烯醇式丙酮酸羧激酶)和fbp(编码果糖-1,6-二磷酸酶)基因,系统研究了糖异生反馈调控的解除对核黄素产量提高的影响。结果表明,与RH33菌株相比,gapB和fbp基因共同过表达的基因工程菌株在摇瓶发酵中的核黄素产量显著提高,达到了最高的4.89 g∙L-1,核黄素产量提高了21.9%,而其在补料分批发酵中的核黄素产量则提高了27.8%。这项研究说明,解除糖异生途径的反馈调控是进一步提高枯草芽孢杆菌核黄素产量的有效策略,且该策略也同样适用于枯草芽孢杆菌中其他直接合成自PP途径的代谢物,以及合成需要NADPH且以葡萄糖为碳源的物质。
Zhang等研究了ribA和ribH基因修饰对枯草芽孢杆菌核黄素产量的影响。结果表明,相比于出发菌株LXZ-1,工程菌LXZ-2由于ribA基因的单独过表达,核黄素产量提高了99%,摇瓶发酵60 h的核黄素产量为0.47 g∙L-1。然而,该工程菌的生物量减少了30%,且由于5-氨基-6-(1-D-核糖醇氨基)尿嘧啶的积累出现了细胞自溶现象。与菌株LXZ-1和LXZ-2相比,基因ribA和ribH在工程菌LXZ-3中共同过表达,使其核黄素产量分别提高了280%和91%,并且未出现生物量下降和细胞自溶的现象。随后,Zhang等又将一个携带有完整rib操纵子的低拷贝数质粒(pMX45)转化到菌株LXZ-3中,得到菌株LXZ-3/pMX45,并将其用于不同碳源(包括葡萄糖、蔗糖、木糖以及不同比例的木糖和蔗糖混合物)对核黄素合成影响的研究。研究发现,当使用比例为1.5∶6.5的蔗糖和木糖混合物(总糖添加量为8%,w/V)作为碳源时,菌株LXZ-3/pMX45在摇瓶发酵60 h后的核黄素产量最高(1.6 g∙L-1),而在5 L发酵罐中发酵70 h后的核黄素产量最高,为3.6 g∙L-1。这项研究表明,蔗糖和木糖的共代谢能够增加核黄素生物合成前体物质的供应,从而提高核黄素的产量。
诺瓦丝菌素(norseothricin, NTC)是一种能抑制蛋白质生物合成的链丝菌素类抗生素,广泛应用于细菌、真菌、酵母和植物细胞的抗性筛选。Cheng等首先利用基因工程技术将sat基因(编码链丝菌素乙酰转移酶)插入到表达质粒pMA5中,构建了一种新型的、具有NTC抗性的重组质粒pMA5-sat,并随后将zwf基因(编码葡萄糖-6-磷酸脱氢酶,G6PD,核黄素生物合成关键酶之一)整合至该重组抗性质粒中,得到重组质粒pMA5-sat-zwf。最终,该重组质粒被转化到产核黄素菌株B. subtilis RF1中,用以研究zwf基因过表达对核黄素合成的影响。结果表明,与原始菌株B. subtilis RF1相比,重组菌株B. subtilis RF1-pMA5-sat-zwf的G6DP活性提高了50倍,说明G6PD成功过表达。该重组菌株在5 L发酵罐中发酵的最终核黄素产量达到12.01 g∙L-1,比RF1菌株提高了30.3%。这些结果说明,新构建的NTC抗性质粒pMA5-sat在产核黄素枯草芽孢杆菌的基因改造中具有潜在的应用价值。
此外,根据Hemberger等的报道,来源于达窝链霉菌(Streptomyces davawensis)的RibM在枯草芽孢杆菌中是一种非能量依赖的功能性核黄素转运体,主要促进核黄素的外排。将达窝链霉菌的ribM基因转化至一株能够高效生产核黄素的枯草芽孢杆菌中,获得的RibM高表达重组菌株的核黄素产量提高,且提高的程度主要取决于诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)的用量。这是基于核黄素外排的枯草芽孢杆菌核黄素产量优化的首个成功案例,说明了增加核黄素的外排量也是提高枯草芽孢杆菌核黄素产量的有效策略之一。
除了代谢工程方法之外,发酵条件的优化也是一种提高枯草芽孢杆菌核黄素产量的可行方法。
培养基的溶解氧是发酵过程中最重要的参数之一,与细胞的生长和产物的合成密切相关。因此,溶解氧的浓度是枯草芽孢杆菌中核黄素合成的一个关键因素,其提高可以通过搅拌速度的改变轻易实现。Man等研究了补料分批发酵中搅拌速度对重组工程菌B. subtilis RF1核黄素产量的影响。动力学分析结果显示,发酵初期较低的搅拌速度(600 r·min-1)可以促进细胞的生长和核黄素的合成,而发酵后期则需要更高的搅拌速度(900 r·min-1)。在此基础上,Man等制定了一种二段控制策略,即在发酵的前26 h将搅拌速度设置为600 r·min-1,随后调至900 r·min-1直到发酵结束,以期在整个发酵过程中维持较高的细胞生长速度和核黄素产量。然而,二段控制策略中搅拌速度的突然切换,会在短时间内对细胞的生长和核黄素的合成造成负面影响。因此,Man等随后建立了一个搅拌速度从600 r·min-1逐渐增加到900 r·min-1的新策略。在该策略下,发酵48 h的核黄素产量达到最高的9.4 g∙L-1,转化率为0.051 g∙g-1葡萄糖。与单一搅拌速度(600 r·min-1)下的补料分批发酵的最好结果相比,核黄素的产量和转化率分别提高了20.5%和21.4%。
以寻找合适的核黄素合成促进剂为目的,Wan等以细菌密度(OD600)和核黄素产量为评价指标,研究了7种添加剂的单独添加对枯草芽孢杆菌在摇瓶发酵中的核黄素产量的影响,包括葡萄糖酸钙、柠檬酸、柠檬酸钠、氯化钙、丙氨酸、苹果酸和1,6-二磷酸果糖(FDP)。研究结果表明,葡萄糖酸钙、柠檬酸钠和丙氨酸的添加对核黄素产量的提升效果最为显著。因此,这三种添加剂被筛选用于进一步的正交试验,以研究它们对核黄素合成的综合影响。结果显示,当葡萄糖酸钙、柠檬酸钠和丙氨酸的最佳浓度比例为7.5 g∙L-1、5 g∙L-1、1.5 g∙L-1时,核黄素产量达到最高的6.46 g∙L-1,比无添加剂时提高了大约40%。
在最近的一项研究中,Oraei等评价了13种不同矿物质[CaCl2、CuCl2、FeCl3、FeSO4、AlCl3、Na3MoO4、Co(NO3)2、NaCl、KH2PO4、K2HPO4、MgSO4、ZnSO4和MnSO4]对野生型B. subtilis ATCC 6051菌株在摇瓶发酵中核黄素产量的影响,旨在开发合适的发酵培养基以提高核黄素产量。该研究首次采用Plackett-Burman (PB)设计法筛选对核黄素合成有显著影响的矿物质。结果显示,MgSO4、K2HPO4和FeSO4三种矿物质的浓度对核黄素合成的影响最大。随后,采用响应面法(response surface methodology, RSM)进行优化试验,以确定所筛选出的五种培养基组分的最佳浓度(g∙L-1),包括所有试验中均有使用的两种碳源(果糖和酵母提取物),以及三种矿物质(MgSO4、K2HPO4和FeSO4)。当这5种组分的浓度分别为38.10 g∙L-1、4.37 g∙L-1、0.85 g∙L-1、2.27 g∙L-1和0.02 g∙L-1时,摇瓶发酵72 h后的核黄素产量最高(11.73 g∙L-1)。
4. 乳酸菌
乳酸菌(lactic acid bacteria, LAB)是一类不形成孢子的、不呼吸的、通常无运动性的革兰氏阳性杆菌或球菌,乳酸是其糖类发酵的主要或唯一终产物。该菌种与人类生活密切相关,乳酸菌创造的酸性环境及其产生的抗菌物质如细菌素,能够抑制发酵食品中许多腐败菌和致病菌的生长。从古代起,乳酸菌就被经验性地用作发酵剂,用于加强食品的生物保鲜。如今,乳酸菌在世界范围内被合理地用作食品工业中的乳酸发酵剂,主要用于各种发酵乳制品(比如酸奶和奶酪)、发酵香肠以及泡菜(发酵蔬菜)的生产。
虽然乳酸菌通常为多种维生素营养缺陷型菌株,但目前众所周知,某些乳酸菌菌种能够合成一些B族维生素,如叶酸(或维生素B9)、核黄素(或维生素B2)和钴胺素(维生素B12)。乳酸菌的维生素合成能力在不同的菌株之间的差异相当大,即具有菌种或菌株特异性,这通常与维生素生物合成遗传信息的(部分或全部)缺失有关。例如,Thakur等利用基于PCR技术的方法对60个乳杆菌中存在核黄素生物合成基因的菌株进行了筛选,并在此基础上利用微生物实验从中筛选具有核黄素合成能力的菌株。最终发现,只有14个菌株可以在无核黄素的商业培养基中生长。基于上述结果的进一步综合分析显示,在不同种类的乳杆菌中,rib操纵子的存在均具有菌株特异性,而缺失的或不完整的乳酸菌rib操纵子通常与核黄素生产能力的丧失联系在一起。根据Kleerebezem等和Burgess等先前的报道,植物乳杆菌Lactobacillus plantarum WCFS1菌株携带有一个不完整的rib操纵子,其中全部的ribG基因和部分的ribB基因缺失,如预期一样,该菌株在没有核黄素的情况下无法生长。然而也有报道称,植物乳杆菌的一些野生型菌株含有完整的rib操纵子并能产生核黄素,例如,从中国传统酱菜汁中分离的L. plantarum RYG-GYY-9049菌株,从泡菜中分离的L. plantarum NCDO 1752,以及从天然酸面团中分离的L. plantarum UNIFG1和UNIFG2。总的来说,乳酸菌rib操纵子的完整性对核黄素的合成至关重要。
鉴于其对人类健康的重要性及缺乏症的普遍性,核黄素成为由乳酸菌生产且被研究得最多的维生素之一。虽然核黄素通常存在于各种各样的食物中,但由于饮食不均衡,核黄素缺乏症在世界范围内的发生率仍然很高。在这样的背景下,核黄素生物强化食品受到了人们的广泛关注,因为它们代表了一种更天然、更适合消费者、价格更低的化学合成核黄素的替代品,可以满足消费者对天然食品日益增长的需求。乳酸菌对食品工业发酵的适应性及其核黄素生产能力,使它们成为生产食品级核黄素的理想候选菌种,为富含核黄素的新型功能食品的开发提供了新的机遇。因此,从各种食物源中筛选野生型产核黄素乳酸菌已引起众多研究者的兴趣。此前有报道称,其从各种食品中分离得到了179株乳酸菌,然而仅42株菌株能够在无核黄素的商业培养基中生长。在这些菌株所产的核黄素浓度(高效液相色谱法测定)基础上,5株具有较高核黄素生产能力的菌株(胞外核黄素浓度为190 ~ 260 ng∙mL-1)最终被筛选出并应用于豆奶发酵中,以评估它们在这种食物基质中的生长情况和核黄素合成能力。结果显示,在37 ℃下发酵12 h后,仅L. plantarum CRL 725菌株产生的核黄素浓度从最初的309 ng∙mL-1显著增加到700 ng∙mL-1。在另一项从生羊乳和奶酪中筛选野生型产核黄素乳酸菌的研究中,共179株野生型乳酸菌被分离出,其中仅8株菌株能够在无核黄素的培养基中生长,产生的核黄素浓度为173 ~ 532 ng∙mL-1。
然而,在使用从食物或其他来源筛选得到的野生型乳酸菌菌株进行发酵生产时,核黄素的产量和转化率都相对较低,这是因为某些特定生物活性物质(如核黄素)的最大产率并非它们的自然优化目标。因此,提高这些菌株的核黄素生产能力以实现核黄素的高产仍然是一个挑战。为了达到这一目标,通常采用的策略有两种,即具有玫瑰黄色素抗性菌株的筛选以及基于代谢工程的重组菌株的构建。
玫瑰黄色素(roseoflavin)是FMN和核黄素的天然毒性类似物,可直接与FMN核糖开关结合,继而抑制rib操纵子的转录。暴露于这种抗菌物质之中可引起产核黄素乳酸菌的自发突变,从而产生核黄素高产菌株。该策略已成功应用于枯草芽孢杆菌、乳酸乳球菌、植物乳杆菌、肠膜明串珠菌(Leuconostoc mesenteroides)和费氏丙酸杆菌(Propionibacterium freudenreichii)等食品级菌株的天然核黄素高产突变体的筛选中,并被证明是切实可行的。
P. freudenreichii NIZO B2336是一株筛选自野生型P. freudenreichii NIZO B374菌株的自发抗玫瑰黄色素突变体,其核黄素产量高于原始菌株。当这两个菌株被用作附属发酵剂(添加时间为酸奶发酵剂Campina MUH306添加前的24 h)进行酸奶发酵试验时发现,以P. freudenreichii NIZO B2336菌株为附属发酵剂生产的酸奶中核黄素的最终含量为19.7 μg∙g-1,高于未添加附属发酵剂的酸奶(12.9 μg∙g-1)以及添加了附属发酵剂P. freudenreichii NIZO B374的酸奶(10.5 μg∙g-1)。这项研究证实了P. freudenreichii NIZO B2336菌株可用于富含核黄素的新型发酵乳产品的开发,而新产品则可能会带来更多的健康效益。
如上文中所提到的,Juarez del Valle等筛选了一株具有较高核黄素生产能力的L. plantarum CRL 725菌株,用其发酵豆奶可使核黄素的浓度提高至初始浓度的两倍。在该菌株的抗玫瑰黄色素突变体的进一步筛选中发现,其中一株突变体(命名为CRL 2130)可使发酵豆奶中核黄素的浓度增至初始浓度的6倍(从309 ng∙mL-1到1860 ng∙mL-1)。这一研究表明,具有玫瑰黄色素抗性的菌株能够被用于营养价值更高、富含核黄素的新型大豆制品的开发。
此外,Russo等从酸面团中分离出一株野生型的产核黄素发酵乳杆菌(命名为Lactobacillus fermentum PBCC11),并随后对其抗玫瑰黄色素突变体进行了筛选。结果表明,在所获得的15株突变体中,7株突变体的核黄素产量超过了1 mg∙L-1。其中,核黄素产量最高(1.203 mg·L-1)的一株突变体(命名为L. fermentum PBCC11.5)被进一步用于与商业酿酒酵母(Saccharomyces cerevisiae)共接种发酵面包,以增加面包的营养物。与传统面包相比,如此发酵获得的面包中的核黄素含量大约增加了两倍,达到了6.66 μg∙g-1,最近,我们成功地从中国传统酱菜汁中筛选出一株天然核黄素高产植物乳杆菌(命名为Lactobacillus plantarum RYG-YYG-9049),其核黄素产量为0.734 mg∙L-1。随后,我们利用玫瑰黄色素诱导该菌株的自发突变,在所获得的抗玫瑰黄色素突变体中,第10号突变体(命名为L. plantarum RYG-YYG-9049-M10)的核黄素产量最高。当将该突变体用于豆浆发酵时,在优化的条件下可使发酵豆浆中的核黄素含量达到2.920 mg∙L-1。
根据先前的报道,玫瑰黄色素诱导的自发突变主要包括rib操纵子上游调控区基因的缺失 和(或)单碱基的改变。然而,我们在最近的研究中发现了一种新的突变类型,即由玫瑰黄色素诱导的、在rib操纵子上游调控区一段大小为1059 bp的DNA片段的插入,该突变可能是引起菌株核黄素产量增加的主要原因。这一发现表明,由玫瑰黄色素介导的突变能够影响终止子结构的稳定性,减少终止子的形成,从而使rib操纵子能够持续转录,然而其确切的机制仍需进一步的研究。
因此,乳酸菌菌种/菌株的合理选择和发酵条件的优化是提高酸奶、奶酪和面包等发酵食品中核黄素含量的可行策略。新型功能性发酵食品中核黄素含量的提升,既可增加食品本身的营养价值,又可为消费者带来健康效益。
代谢工程技术通常用于核黄素合成能力提高的重组菌株的构建。Burgess等将ribG、ribB、ribA和ribH 4个rib结构基因以不同的组合方式克隆到表达载体pNZ8048中,并随后将构建的重组表达载体分别转化到Lactococcus lactis ssp. cremoris NZ9000菌株中,以阐明rib基因过表达对核黄素合成的影响。研究发现,只有携带重组质粒pNZBAH的L. lactis NZ9000菌株(共同过表达4个rib基因)的核黄素产量较高(24 mg∙L-1)。由此,作为核黄素消耗菌的L. lactis NZ9000被成功转化为核黄素生产菌。
通过暴露于玫瑰黄色素中,Sybesma等从L. lactis NC9000中分离到一株产核黄素的突变体,基因序列分析结果显示,该突变体L. lactis CB010仅在 rib基因上游调控区内发生了一个碱基的改变。随后,Sybesma等将编码氨基-4-羟基-6-羟甲基二氢喋啶焦磷酸激酶和GTP环水解酶I的双功能酶基因folKE克隆到质粒pZ8161中,得到重组质粒pNZ7017并将其转化到突变菌株L. lactis CB010中。结果发现,当folKE基因在产核黄素的重组工程菌株(携带有质粒pNZ7017的L. lactis CB010)中过表达时,叶酸的产量也同时增加。因此,借助于代谢工程,实现了叶酸和核黄素在乳酸乳球菌中的同时过量合成。
作为核黄素和叶酸的共同前体物质,GTP既可以被GTP环水解酶II(由ribA基因编码)用于核黄素的生物合成,也可以被GTP环水解酶I(由folE基因编码)用于叶酸的生物合成。因此,这两种酶之间存在着对GTP分子的竞争,而folE基因的失活可能会提高GTP的供应量,从而促进核黄素的产生。L. fermentum MTCC 8711是一株从酸奶中分离到的野生型产核黄素菌株,其核黄素合成能力在folE基因失活后得到提高。在CDM培养基中发酵24 h后,L. fermentum MTCC 8711菌株的核黄素产量为2.29 mg∙L-1,且该产量可稳定维持到72 h,然而folE基因阻断的菌株L. fermentum GKJFE发酵72 h后的核黄素产量为3.49 mg∙L-1,比其亲本菌株L. fermentum MTCC 8711提高了约50%。
对于微生物发酵生产核黄素而言,代谢工程成为一种利用没有或只有较低核黄素合成能力菌株的重要且可靠的生物技术。然而,由于消费者或监管机构对基因工程的担忧,到目前为止,基因工程菌仍不能应用于供人类食用的食品发酵中。
四、结论
本文综述了近年来在微生物高产核黄素方面取得的研究进展,主要集中于发酵条件的优化以及源自于化学诱变和代谢工程的核黄素高产菌株的使用。与全化学合成法和化学半合成法相比,微生物发酵法生产核黄素更为经济、环保。为了取代成本较高的化学合成工艺,近年来开发了许多基于枯草芽孢杆菌和棉阿舒囊霉菌使用的生物技术发酵工艺,其已被应用于工业生产。然而,由于每种微生物都有其优缺点,因此哪种微生物最具优势且能取代其他微生物,目前尚无定论。尽管细菌的核黄素生产能力较低,但与传统的核黄素消耗型发酵剂相比,其更适合用作食品发酵的发酵剂。富含核黄素的发酵食品不仅可以提高食品本身的营养价值以及商业价值,还可以消除人们对营养强化的需求。此外,这种新型发酵食品食用将有望降低核黄素缺乏症的发生率。最后,利用精心挑选的菌株进行核黄素原位生产的理念,为开发面向不同或特定人群(如老年人、儿童、孕妇、运动员、素食者和青少年)的新型食品开辟一条途径。

来源:中国工程院院刊


