今日头条
智康弘义肾科新药获批II期临床。智康弘义研发的全新ETA受体小分子拮抗剂SC0062胶囊获国家药监局临床试验默示许可,拟用于伴有蛋白尿的慢性肾脏病,包括糖尿病肾脏病和IgA肾病等。SC0062已在完成的Ⅰ期临床中显示出良好的安全性、耐受性以及药代动力学特征,未发现水钠潴留等副作用,有望成为潜在的“Best-in-Class”药物。智康弘义计划尽快启动SC0062的Ⅱ期临床。
国内药讯
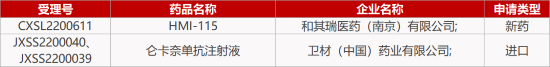
1.复星引进TPO-R激动剂新适应症报产。复星医药引进品种小分子创新药马来酸阿伐曲泊帕片的新适应症上市申请获CDE受理,推测适应症为免疫性血小板减少症。阿伐曲泊帕是一款血小板生成素受体(TPO-R)激动剂,已于2018年5月获FDA批准上市,成为全球首个用于治疗慢性肝病相关的血小板减少症的口服药物。2020年4月,马来酸阿伐曲泊帕片以商品名“苏可欣”在国内首次获批上市。
2.卫材Aβ抗体治疗AD在华报NDA。卫材开发的Aβ抗体仑卡奈单抗(lecanemab)注射液的上市申请获CDE受理,适应症为轻度阿尔茨海默症(AD)和阿尔茨海默症(AD)引起的轻度认知障碍(MCI)疾病的改善治疗。发表在《新英格兰医学杂志》的III期Clarity AD试验结果显示,lecanemab较安慰剂使患者临床痴呆评分总和(量化痴呆症状的各种严重程度,CDR-SB)下降减少27%,患者大脑中淀粉样蛋白水平显著下降59.1centiloids。
3.圣诺双靶点RNAi新药早期临床积极。圣诺制药siRNA候选药物STP707在美国针对多种实体瘤类型的I期篮式研究结果积极。STP707利用双靶向抑制特性和PNP药物递送技术,通过静脉给药,增强药物向实体瘤和转移性肿瘤靶向递送的效果。这项临床20例受试者的数据显示,有8例受试者的反应时间等于或超过两个治疗周期或56天,并在治疗100天后疾病呈现稳定。
4.上海舶望siRNA药物获批Ⅰ期临床。上海舶望制药自主研发的首款siRNA新药的Ⅰ期临床试验申请获澳大利亚药监局(TGA)批准。舶望制药成立于2021年4月,专注于新一代siRNA药物的开发。目前该公司已完成超4亿元A轮融资,正在积极推进多条临床前研发管线,已有多条管线处于IND-enabling阶段,预计到2023年会有多个在研药物获批临床试验申请。
5.康万达IL-21溶瘤痘病毒报IND。杭州康万达医药开发的“重组人IL-21溶瘤痘病毒注射液(hV01)”临床试验申请获CDE受理。这是一种分离的重组溶瘤痘病毒,属于TK基因和VGF基因功能缺陷型;该重组溶瘤痘病毒的基因组中整合有外源IL-21基因,并且该IL-21基因能够在肿瘤细胞中表达。据悉,这是国内首个申报IND的携带IL-21免疫细胞调控因子的溶瘤痘病毒产品。
国际药讯
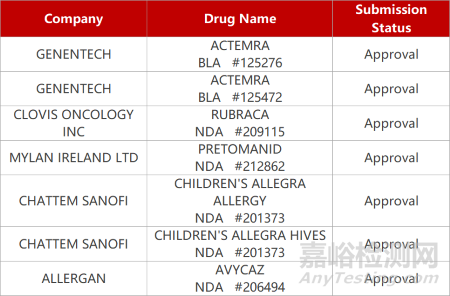
1.罗氏「托珠单抗」获批新冠适应症。FDA批准罗氏托珠单抗(Actemra)静脉注射用于治疗新冠病毒肺炎(COVID-19)住院成年患者。托珠单抗是一款IL-6拮抗剂,FDA曾于去年6月授予托珠单抗紧急使用授权,用于住院成人和患有 COVID-19 的2 岁及以上儿童。在临床研究RECOVERY中,tocilizumab提高了COVID-19住院患者的生存率,缩短了患者住院时间,并降低了患者对机械通气的需求。
2.欧盟批准奥拉帕利一线治疗前列腺癌。阿斯利康与默沙东联合开发的PARP抑制剂奥拉帕利(olaparib,Lynparza)获欧盟委员会(EC)批准新适应症,与阿比特龙(abiraterone)、强的松(prednisone)联用,一线治疗转移性去势抵抗性前列腺癌(mCRPC)的成人患者。在Ⅲ期PROpel临床中,奥拉帕利组合疗法使疾病进展或死亡风险降低34%(HR=0.66,95% CI:0.54-0.81,P<0.0001),中位rPFS达到24.8个月(95% CI:20.5-27.6),且联合治疗的安全性与之前研究一致。
3.辉瑞S1P调节剂在美国和欧盟报产。辉瑞宣布其S1P受体调节剂etrasimod的新药上市申请(NDA)已获FDA受理,用于治疗中重度活动性溃疡性结肠炎(UC)患者。该公司同时宣布欧洲药品管理局(EMA)也受理etrasimod用于相同适应症的上市许可申请(MAA)。在Ⅲ期ELEVATE UC 52研究中,etrasimod组第52周时患者达到32.1%(vs6.7%,p<0.001)的临床缓解率。云顶新耀拥有etrasimod在大中华区的开发权益。
4.辉瑞口服GLP-1受体激动剂上Ⅱ期临床。辉瑞与Sosei Group Corporation开发的GLP-1受体激动剂PF-07081532在Ⅱ期临床中完成首例患者给药。今年9月,辉瑞公布PF-07081532在2型糖尿病和肥胖症患者中进行的Ⅰb期临床积极数据,患者接受PF-07081532治疗6周后,其空腹血糖水平接近正常阈值;最高剂量组体重较基线降低约10斤。此外,药物的安全性与同类药物相似。
5.单价流感疫苗贴片早期临床积极。Vaxess公司基于其专有MIMIX 缓释贴片技术开发的季节性H1N1流感疫苗贴片VX-103,在I期临床中获得积极中期结果。VX-103只需佩戴在皮肤上,疫苗贴片就能将H1N1流感抗原缓释输送到具有免疫活性的真皮中并释放有效载荷。第57天的数据显示,VX-103(15ug、7.5ug)的血清转换率分别为85%和77%,两组的血清保护率皆为92%。疫苗贴片的总体耐受性良好。
6.BAFFR靶向CAR T早期临床积极。PeproMene Bio公司自体BAFFR-CAR T细胞疗法PMB-CT01治疗复发或难治性非霍奇金淋巴瘤(r/r B-NHL)的Ⅰ期临床结果积极。首例患者在治疗一个月后达到完全缓解。在治疗期间,患者仅出现低水平治疗所导致的急性毒性,包括1级细胞激素释放症候群("CRS")并完全恢复,也未出现免疫效应细胞相关神经毒性综合征("ICANS")。
医药热点
1.“浙里心晴”心理服务平台上线。近日,浙江省卫健委开展社会心理服务体系建设,创新打造出社会心理服务平台“浙里心晴”。该平台面向全省公众,特别是有失眠、压力及抑郁等情绪困扰或心理问题的群体,提供心理科普、AI心理咨询、心理测评、心理热线、预约挂号等服务,帮助民众疏导情绪,培育积极向上、理性平和的社会心态。
2.杭州明确“无症状及轻症”可申请集中隔离。12月21日,杭州市召开新冠病毒肺炎疫情防控工作新闻发布会。针对“杭州无症状、轻症人员是否可申请集中隔离”提问,有关领导明确表示,杭州市已按1808号《工作提示单》储备建设一批“健康之家”,目前全市已储备16030间隔离用房。申请人可向所在社区提出申请,健康之家会按要求提供相应的服务,住宿费价格不高于正常经营期间的市场价,餐费不高于每人每天100元。
3.上海呼吁把120留给真正有需要的人。随着新冠感染人数上升,上海市“120”呼入数量骤增,中心城区救护车运行面临巨大压力。上海市急救中心正在不断新增当班车、尽可能满足市民急救需求,同时也呼吁广大市民,新冠感染的轻症患者不要因为恐慌或者咨询而拨打“120”,把“120”生命热线和宝贵的救护车资源,留给真正需要急救的患者。
评审动态
1. CDE新药受理情况(12月22日)
2. FDA新药获批情况(北美12月21日)