您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-26 14:31
近期,美国斯蒂文斯理工学院王红军教授和南开大学朱美峰研究员在Bioactive Materials上联合发表研究文章:通过3D打印聚电解质复合物制作用于组织再生的多孔道生物支架。限制组织工程临床转化的关键因素之一,是无法创建大体积并拥有复杂三维结构的再生组织。在这里研究者通过嵌入式3D打印(EB3DP)聚电解质复合物(PEC)和浇铸的方法,实现了在支架内创建微通道网络。
01研究内容简介
在体外制造组织工程构建物或在体内进行病变或受损组织的修复时,支架引导的组织再生仍然是主流。通常情况下,由不同材料制成的支架将为贴附细胞创造一个适宜的生长微环境。一般来说,这种支架应具备一个相互连接的孔道网络,孔道具有理想的尺寸、精巧的分层结构和优化的生物学分区。具备孔道的生物支架材料不仅能促进可控的细胞活动(如附着、迁移和分化),并且能在新组织形成期间带来充足的营养供给。越来越多的证据表明,在支架设计中纳入结构的复杂性可以更好地模仿细胞外基质(ECM)的独特机械和生物功能,并在空间中引导形成具有取向性的生物组织,如血管和神经元网络。
因此,本研究打算开发一种广泛适用的方法,探索使用聚电解质复合物(PEC)作为打印墨水,生产制备具有任意形态的可牺牲模板支架,并广泛匹配各种浇铸材料(如聚合物熔体、合成和天然聚合物溶液、热敏水凝胶和光交联水凝胶),通过PEC对外部刺激(如pH值和离子浓度)的敏感解离反应,制造出含有三维分层和任意通道结构的生物支架(图1)。这项研究不仅证明了在生物支架内创建分层通道网络的可能性,而且还提供了一个有效的途径来快速可重复地设计孔道结构,以便在组织工程领域对具有各向异性和复杂性的细胞进行空间引导再生。
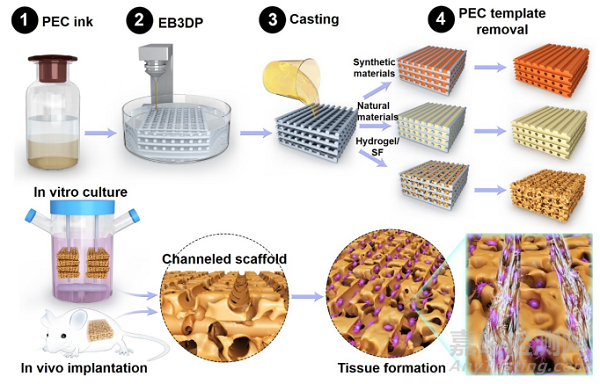
图1. 通过3D打印的可牺牲聚电解质复合物(PEC)模板辅助策略,形成具有三维分层、任意构型的多功能孔道支架的关键步骤示意图。
一、可打印的PEC墨水的制备与表征
聚(二烯丙基二甲基氯化铵)(PDADMAC)和聚(4-苯乙烯磺酸钠)(PSS)的聚电解质被认为是一个充满潜力的PEC耦合对,它们表现出良好的结合强度、快速的结合速率、对离子强度的敏感性(结合/解离)、对高温的耐受性(高达350℃)、相对较高的硬度(∼10MPa)和可忽略的细胞毒性。如图2A所示,将PDADMAC和PSS以单体单位2.50M的浓度以1:1的体积比混合,通过内在的静电相互作用可以导致快速结合(<1分钟)生成PEC。从理论上讲,许多类型的盐可以用来部分或完全解离PEC,并呈现可调节的粘度。解离速度主要依赖于生成PEC的电解质耦合对的强度、离子扩散系数和盐的解离速度。溴化钾(KBr)在本研究中被特别选择,因为它被证明有能力比氯化钠更快地达到掺杂平衡。如图2B所示,随着KBr浓度的增加,PDADMAC/PSS复合物逐渐被来自PEC "外在位点 "的反离子(即K+和Br-)补偿。在较低的KBr浓度(≤1.50M KBr)下,PEC被塑化,同时保持物理上的完整。当KBr浓度增加到1.75M时,PEC变成了一种粘稠的液体(称为 "共析物"),其粘度适合于挤出打印,不会因为剪切引起的压力下降而堵塞打印喷头(图2C)。随着KBr浓度的进一步增加(≥2.00M KBr),PEC中预耦合的PDADMAC/PSS被KBr离子完全解离,形成一个均匀的溶液。鉴于PEC(PDADMAC/PSS)通过添加水或高浓度KBr可逆的沉淀/溶解机制,它不仅提供了一个可控的方法来调节PEC墨水的粘度以便进行3D打印,而且还提供了一个方便和 "绿色 "的手段来去除和回收作为牺牲模板的PEC支架。如图2D所示,PEC支架可以迅速溶解在2.00M的KBr溶液中,并在降低KBr浓度后重新沉淀。在离心和清洗后,沉淀的PEC可以被收集并重新溶解在1.75M的KBr中,形成可打印的凝聚物,使环保和成本效益达到了平衡。
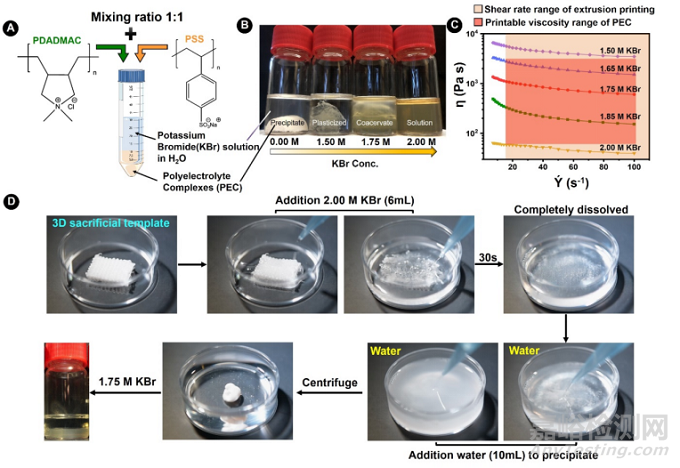
图2. PEC打印墨水关键参数优化和PEC可牺牲模板的回收过程。A)用于嵌入式3D打印(EB3DP)的PEC墨水的制备示意图。B)不同浓度KBr水溶液中PEC沉淀物溶解的宏观图像。C) 溶解在不同浓度的KBr溶液中的PEC的流变曲线。D) 3D打印的PEC模板的完整回收过程。
二、在Pluronic 127水凝胶中进行嵌入式3D打印制备PEC可牺牲支架
为了利用嵌入式3D打印制备任意形貌的PEC可牺牲支架,研究者利用了三嵌段共聚物Pluronic F127的热可逆凝胶行为,使其扮演打印支撑基质(图3A)。25%(w/v)的Pluronic F127水溶液可在室温(临界点温度为22℃∼)下凝胶化,同时表现出 "剪切稀化能力",即为水凝胶剪切应力因移动的打印喷头的剪切速率增加而急剧下降。在这方面,研究者测试了与剪切应力有关的储存模量的变化。如图3C所示,25%(w/v)的Pluronic F127(约30千帕)的储存模量随着剪切应力的增加而减少,这表明快速移动的打印喷头能通过剪切稀化作用使水凝胶局部液化,而随着打印停止,Pluronic 127可以恢复凝胶状态。另一方面,25%(w/v)的Pluronic F127剪切稀化特性也赋予了它自我修复的能力,可以立即填补打印喷头快速移动造成的空隙,进而防止印刷结构因喷头移动而发生潜在的变形(图3B)。同时,Pluronic F127中存在水分也能使得打印的PEC快速凝固成型。此外,Pluronic F127的热响应相变将允许其在临界温度下迅速转化为水溶液以释放打印的可牺牲支架。
嵌入式3D打印的可控性和其他相关的边界条件也在文中得到了逐一探究。图3B示意性地说明了嵌入式3D打印的的装置,其中PEC墨水以泵送速率Vp从一个内径为Dn,移动速度为Va的打印喷头(26G)中挤出。由于其自身弹性和挤出的PEC的相关剪切稀化作用,预计会出现模具膨胀,即打印的纤维直径D'大于Dn。这种模胀现象无疑会限制纤维直径D'的大小,从而限制了打印的分辨率。幸运的是,这样的问题可以通过在嵌入式3D打印过程中,在25%(w/v)Pluronic F127内塑化和拉伸PEC来部分克服。如图3E所示,由于PEC和25%(w/v)的Pluronic F127之间不均匀的离子交换,凝固的PEC层会瞬间形成,包裹住挤出的PEC墨滴。同时,PEC墨水和Pluronic F127支撑基质之间的内在弹性模量差异允许将打印的PEC拉伸成具有均匀直径D的纤维,这一过程也促进了离子扩散,以防止串珠或拖尾结构的形成(图3D)。最终,塑化/拉伸的稳定状态达成,其水含量、重新耦合的PEC对和周围的反离子(图3E)达到微妙的平衡。这保证了制造出具有高保真度和良好机械稳定性的PEC可牺牲支架。研究还发现,通过分别调节Va和Vp,进而可以控制打印纤维的粗细与形态(图3F与3G)。例如,当Vp/Va比率大于0.67μL mm-1时,由于印刷速度相对较慢,过多的PEC会积聚在打印喷头的尖端,导致打印结构的破坏。相反,当Vp/Va比值低于0.008 μL mm-1时,过快的喷头移动会将有限的PEC拖过支撑基体,导致扁平的纤维甚至串珠的形成。
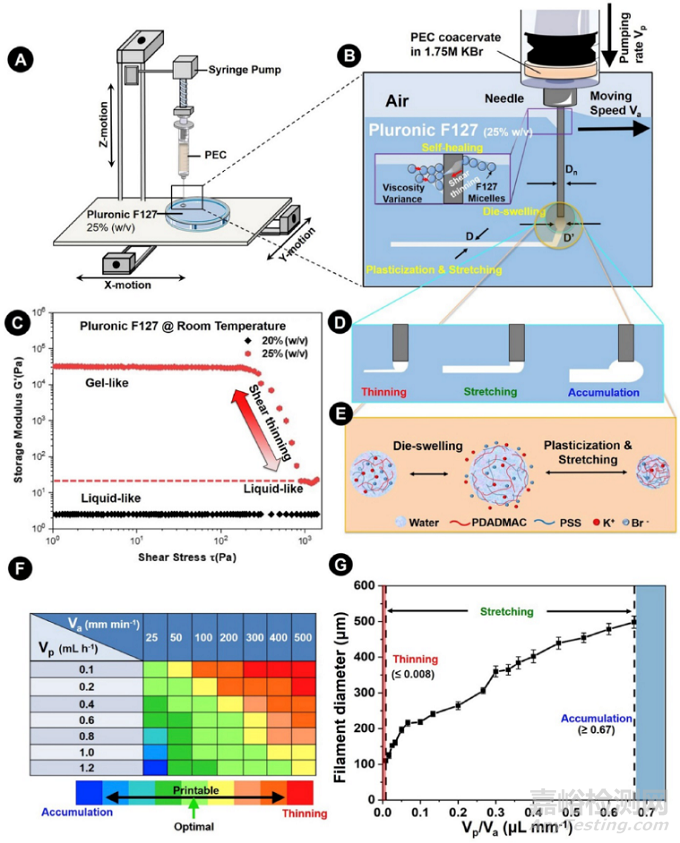
图3. 与制造PEC可牺牲模板有关的关键参数的优化。A)自制的3D打印机和嵌入式3D打印的示意图。B)嵌入式3D打印过程示意图。C)两种浓度的Pluronic F127在室温下的流变特性。D) 三个打印边界条件的示意图。E)在PEC打印纤维的形成过程中,25%(w/v)水溶液中的反离子、水和PEC耦合对的再平衡的示意图阐述。F)Va和Vp的彩色编码图与PEC可打印性。G)1.75M KBr PEC共析物的纤维直径与Vp/Va比值之间的相关性。
本研究还探索了打印各种叠加角度(15°、30°、45°、60°、75°和90°)(图4Ca-f)、复杂图案(三角形、波浪形和蜂窝状)(图4Cg-i)和多层叠加(图4Cj-l)的PEC纤维结构。特别是,多层PEC蜂窝图案是以大尺寸(2厘米×2厘米×0.3厘米)连续和逐层打印的。每一层都有清晰的边界(图4Cl),这表明嵌入式3D打印可以随时扩大规模,生产大型复杂的结构。与水凝胶和基于糖熔体的结构相比,打印的PEC结构表现出适度的机械强度和良好的灵活性。对干燥的10层PEC网格(图4Da)进行循环压缩试验,以90°覆盖角从顶部或侧面加载(图4Db-c),证明了其从变形中恢复的能力,并没有产生分层或结构崩溃。除了干燥状态,湿的6层PEC蜂巢结构也通过用镊子手动折叠来评估其弹性和结构稳定性(图4E)。事实上,这里所测试的性能对于在不同的浇铸材料上使用打印的PEC构作为牺牲模板是至关重要的。

图4. 在嵌入式3D打印过程中,PEC微纤维的不同空间构型和相关的机械稳定性。A) 各种纤维直径和纤维间距离的立体显微镜图像。比例尺:a)500μm;b)200μm。B)PEC纤维的SEM显微照片。L-a)从1.75M KBr PEC共析物中打印的纤维的形态(L-b)。从1.75M KBr PEC共析物中提取的直径为L-c)120 μm、L-d)200 μm和L-e)500 μm的PEC纤维的横截面。比例尺:a)200μm;b)50μm;c)20μm;d)50μm;e)100μm。C) 15°到90°不同叠加角度的PEC纤维的立体显微镜图像,复杂的图案和多个叠加层。比例尺:a-i)500μm;j-l)2mm。D) 在干燥条件下的打印PEC可牺牲模板的特征。D-a)干燥的PEC模板。D-b)在循环压缩测试下,干燥的PEC模板的机械稳定性的宏观演示。D-c)干燥的PEC可牺牲模板在第1个(蓝色)和第20个(红色)压缩周期后的应力-应变曲线。E)湿的PEC可牺牲模板的宏观视图(a)没有折叠(b)和折叠(c),以显示结构的完整性。
三、在聚(1, 8-辛二醇-柠檬酸)(POC)铸模内形成微通道网络
铸模内互连通道的形成受到打印分辨率、结构稳定性和牺牲模板的可移除性等影响(图5A)。因此,本文试图确定打印的PEC结构是否适合作为可牺牲模板,在聚(1,8-辛二醇-柠檬酸)(POC)铸模内形成可灌注的开放微通道。为了更好地观察POC铸模内的PEC可牺牲模板,在SEM下检查了其横截面。可以很容易地识别出PEC纤维,并看到了从圆形到椭圆形的变形(图5Ba-b),这很可能是由于高温和真空引起的PEC纤维的脱水。PEC去除所需的时间取决于PEC耦合对和反离子。实验使用了PDADMAC/PSS和2.00M KBr,PEC模板从POC铸型中溶解出来的时间为几分钟。在2.00M的KBr水溶液中浸泡15分钟后,PEC模板从POC铸型中完全去除,并通过SEM检查确认其横截面,并形成开放的微通道(图5Bc-e)。正如证实的那样,这些微通道在叠加的PEC纤维的交界处连接良好(图5Bc)。为了更好地评估微通道结构的互连性和质量运输的效率,通过通道POC铸型底部的开口注入库马西亮蓝溶液(0.025%,w/v)(速度为2 mL h-1)(图5Ca)。染料在整个通道中的时间分辨渗透很容易以逐层的方式发生(图5Cb)。同样地,具有其他形貌的打印PEC可牺牲模板也被测试了其在POC铸型内产生多功能开放通道结构的能力(图5D)。在移除PEC模板后,微通道彼此连接良好,并可灌注染料溶液(图5Da-iv-d-iv)。为了更好地观察管腔的空间组织,还对有通道的POC支架进行了Micro-CT分析。如图5E所示,这些由PEC模板(红色标记)形成的微通道显示出三维分层结构,与AutoCAD的设计高度。这些结果显然表明,在打印出来的PEC可牺牲模板的帮助下,一个三维复杂的微通道网络可以有效和可靠地在POC铸件内形成,并可能允许通过生理相关的灌注进行自由质量/氧气运输。
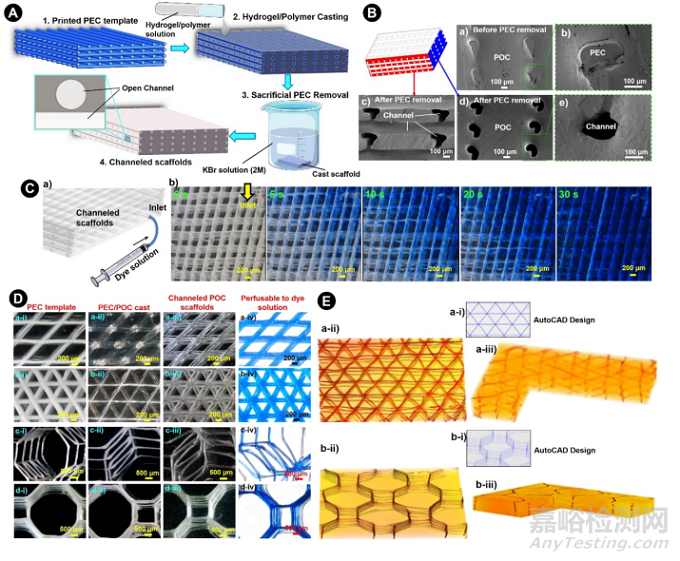
图5. 具有不同形貌的多功能孔道网络的POC支架的形成。A)PEC可牺牲模板在POC铸型内形成相互连接的通道网络的示意图。B)在去除PEC可牺牲模板前后,带有微通道的POC铸型的横截面的SEM显微照片。比例尺。100μm。C) 表征POC铸模内相互连接的微通道的渗透性,其中C-a)中说明了实验设置,C-b)中显示了染色溶液(蓝色)通过通道的延时渗透。比例尺:200μm。D) 具有不同通道结构的孔道POC支架的显微图像(a-iii至d-iii)和渗透性(a-iv至d-iv),这些支架是通过将PEC模板(a-i至d-i)从PEC/POC铸模(a-ii至d-ii)中移除而产生的。比例尺:a-b) 200 μm;c-d) 500μm。E)根据Micro-CT扫描的俯视图(a-ii至b-ii)和侧视图(a-iii至b-iii),确认在POC(黄色)内形成与原始设计(a-i至b-i)类似的理想的开放微通道(红色)。
四、利用PEC可牺牲模板在不同的可浇铸材料中形成微通道
为了进一步确定这种PEC可牺牲模板方法的灵活性和通用性,我们探索了其他常用的天然(如琼脂糖和胶原蛋白)或合成(如GelMA和聚苯乙烯)材料中创造可灌注的微通道(图6A)。更重要的是,这些浇铸材料,依靠不同的方式来凝固(即pH值和热反应的凝胶化,紫外线诱导的交联,以及有机溶剂蒸发),并没有对PEC模板(即5层90°覆盖的网格)造成明显的破坏(图6Aa-d-i&ii)。用2.00M的KBR溶液浸润这些支架以溶解PEC可牺牲模板后,并不影响通道支架的结构完整性。与POC类似,用琼脂糖也观察到热诱导的微通道变形(图6a-iv)。相比之下,其余材料都获得了圆形通道(图6Aa-d-iii和-iv)。有趣的是,根据浇铸材料的不同,观察到PEC纤维(直径200微米)的微通道的收缩率不同。用ImageJ分析显微镜图像,发现琼脂糖的收缩率最高(10.4%),其次是聚苯乙烯(PS,7.2%)、GelMA(5.3%)和胶原蛋白(3.7%)(图6B)。注意到的微通道尺寸的变化很可能是由于在浇铸材料的凝固过程中印刷的PEC模板的失水造成的。显然,与水凝胶(GelMA和胶原蛋白)相比,有机溶剂蒸发(PS为氯仿)和高温处理(琼脂糖为120℃)将不可避免地减少PEC模板的水含量。尽管有收缩,但PEC模板始终支持在这些基质中发展开放和相互连接的微通道。据我们所知,没有其他报道的牺牲性模板证明与如此广泛的可浇铸材料兼容。此外,PEC模板的通道形成也可以很容易地与其他致孔的方法(如冻干、气体发泡和颗粒浸出)相结合,以制造出在孔隙中具有相互连接的分层通道的支架(图6Ca)。例如,在冻干和戊二醛交联后,将PEC模板从40%(w/v)的丝纤维素(SF)中移除,可以在SF基质的微米和亚微米大小的孔隙(2-20μm)中形成微通道(图6Cb-c)。同样,在冻干后,交联的10% GelMA微米大小的孔隙(40-80μm)中可以形成PEC诱导的微通道(图6Ce)。结果支架的MicroCT分析显示,SF支架(76±2%)和GelMA支架(79±3%)的孔隙率相当(图6D)。
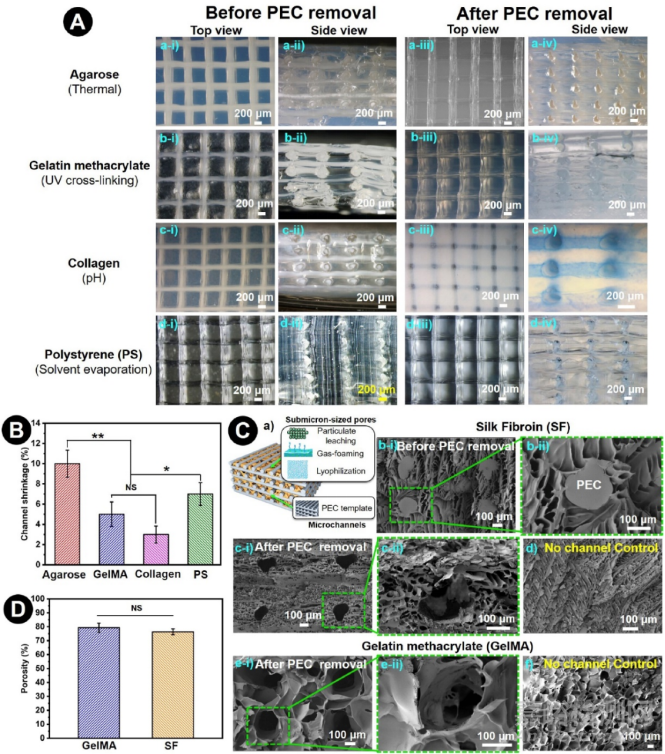
图6. 由多功能可铸生物材料形成的通道支架。A)在(a-i&ii至d-i&ii)和(a-iii&iv至d-iii&iv)去除PEC可牺牲模板之前和之后,由琼脂糖(Aa)、甲基丙烯酸明胶(GelMA)(Ab)、胶原蛋白(Ac)和PS(Ad)制备的通道支架的显微镜图像。B)去除PEC后不同材料内的通道收缩量的量化。(n≥5,*p<0.05,**p<0.001,NS:不显著)。C) 通道网络的发展与其他致孔方法(如颗粒浸出、冻干、气体发泡)相结合(Ca),形成具有多尺度多孔结构的通道支架,如冻干后的SF(Cb-d)和GelMA(Ce-f)。嵌入SF浇铸材料中的PEC模板的SEM显微照片(Cb-i和ii),以及与没有通道的SF冻干支架(Cd)相比,去除PEC模板后冻干孔隙中形成的微通道(Cc-i和ii)。具有额外冻干孔的通道GelMA支架的SEM显微照片(Ce-i和ii),与没有通道的支架不同(Cf)。比例尺。100 μm。D) 通过Micro-CT扫描确定,带有冻干孔的GelMA和SF微通道支架的孔隙率具有可比性。(n≥5,NS:不显著)。
五、孔道支架的体外组织形成
在冻干丝素蛋白的支架中引入微通道,预计不仅能促进其与外界质量交换,还能支持细胞浸润和组织形成。这里,我们选择了三种具有不同通道直径(CD)(200或400微米)和通道间距离(ICD)(600或800微米)的丝素蛋白支架来证明微通道能促进组织的形成。在体外细胞培养方面,用小鼠成纤维细胞(STO细胞,1×105细胞/支架)动态播种,然后在生物反应器中连续搅拌培养(图7A),这表明它有能力实现细胞在支架之间的均匀分布,并支持细胞的持续增殖和ECM沉积。培养的生物支架横截面的H&E染色也显示出更多的细胞和新组织位于内部孔隙中,主要通过微通道生长(图7D)。为了更好地观察新的ECM沉积,还用Masson's三色染色法对胶原蛋白进行了染色。如图7E所示,新合成的胶原蛋白(蓝色)的沉积只发生在非通道的SF支架的外围区域。虽然非通道SF支架的微孔有利于质量交换,但其尺寸可能太小,细胞无法浸润。相反,在另一组的整个微通道中看到了大量的胶原蛋白,证实了这种微通道在促进质量交换和支持新组织形成方面的高效。
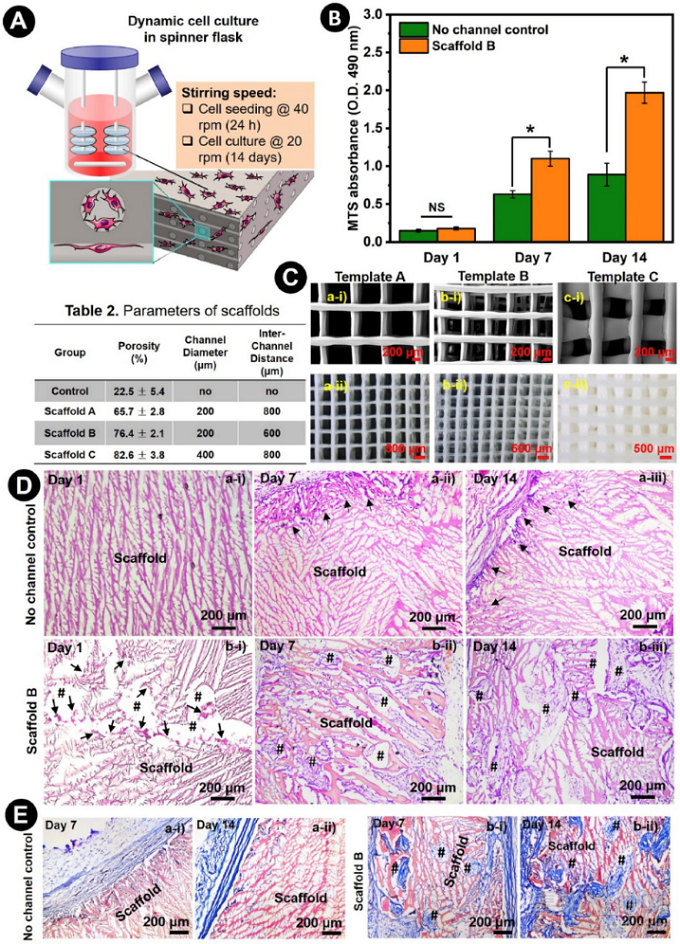
图7. 小鼠成纤维细胞(STO细胞)在有通道和无通道的SF支架内进行体外培养,以评估其对组织形成的支持性。A)细胞播种和在生物反应器内的连续培养条件的示意图。B) 培养1、7和14天后,STO细胞在支架B和非通道对照内的附着和增殖的定量分析。细胞增殖是通过MTS检测间接测量的。(n≥5,*p<0.05,NS:不显著)。C)用于创建不同通道支架的PEC可牺牲模板(A,B,C)的形态。 ai-ci)PEC可牺牲模板的SEM显微照片。比例尺:200μm aii-cii) PEC可牺牲模板的立体显微镜图像。比例尺:500μm。表2总结了不同支架的关键属性。D) 培养的生物支架的H&E染色横截面的代表性显微图像,显示了非通道对照(Da)和支架B(Db)在培养1、7和14天后的细胞分布和组织形成。比例尺:200μm。 #:通道的横截面。黑色箭头:细胞和新形成的组织。D) 培养的生物支架Masson's三色染色横截面的代表性显微图像,以更好地显示非通道对照(Ea)支架B(Eb)内新合成的胶原蛋白(蓝色)以及培养7天和14天后的情况。比例尺:200μm。 #:通道的横断面。
六、孔道支架的体内组织再生和血管化
为了评估孔道支架对组织生长的功效,并探索各种配置(即CD和ICD)与细胞化、血管化和免疫调节的相关性,研究选择了通道式SF支架(支架A、B和C)和非通道式SF支架(对照组)皮下植入Sprague-Dawley大鼠的背部(图8A)。植入2周和4周后的外植体的组织学分析(H&E染色)显示,通道支架的组织主要通过通道生长,这在支架A(图8Bb)中很明显,该支架有一个小的CD(200μm)和大的ICD(800μm)。增加CD(支架C)或减少ICD(支架B)能够明显促进组织的生长(图8Bc和d)。非通道支架上的组织生长极少,只在表层区域或支架周围发生(图8Ba)。与非通道支架或支架A内有限的微血管相比,支架B和C内的微血管数量增加(黄色箭头)。为了更好地观察血管,还进行了Von Willebrand因子(VWF)的免疫荧光染色。如图8中的黄色箭头所示,更多的毛细血管通过支架B和C的微通道形成。显然,细胞浸润和血管化都与相互连接的微通道和增加的孔隙度有很好的关联。在体内植入任何异物都会不可避免地诱发入侵的巨噬细胞的极化,即iNOS阳性的促炎症巨噬细胞(M1)或CD206阳性的抗炎症巨噬细胞(M2)。植入4周后,这些标记物的免疫荧光染色证实,CD206和iNOS阳性细胞分布在整个通道支架的微通道内(图8D)。相比之下,巨噬细胞主要分布在非通道式支架的外围边界区域。图像分析进一步显示,通道化支架中CD206阳性细胞的数量明显高于非通道化对照组,而通道化支架中iNOS阳性细胞的数量与对照组支架接近。这些数据表明,通道化的SF支架具有更好的免疫调节和生物相容性。到目前为止,所有的结果都证明了通道式支架在通过鼓励细胞化和血管化来促进组织生长方面的优越性。
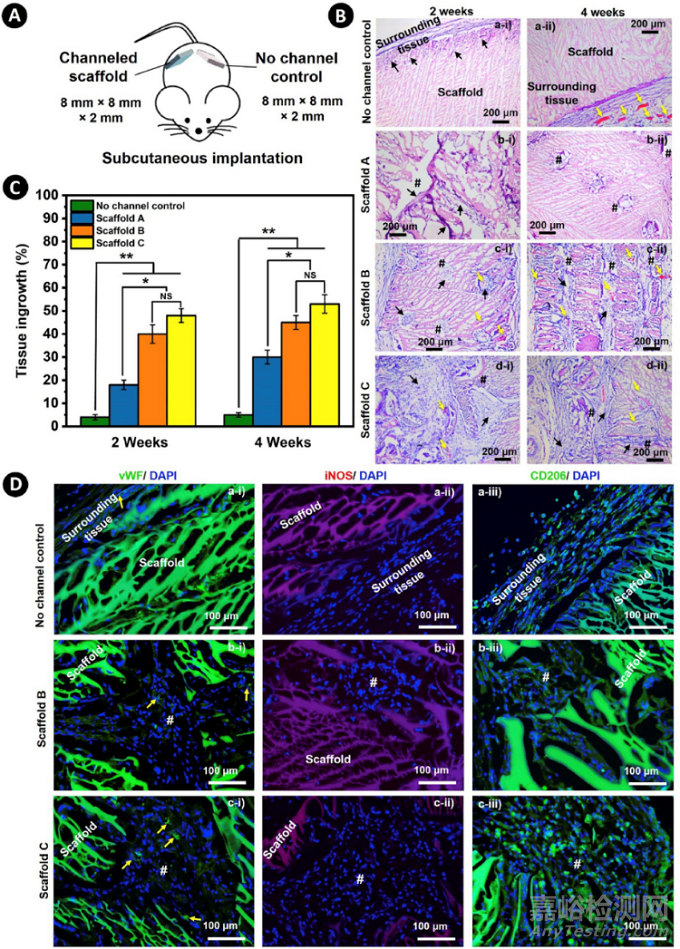
图8. 在体内植入各种有通道和无通道的SF支架以评估微通道对组织生长的影响。A)实验装置的示意图,其中通道支架(支架A、B和C)或非通道支架(对照)被植入大鼠的皮下。B)皮下植入2周(Ba-i至Bd-i)和4周(Ba-ii至Bd-ii)后,外植体的H&E染色截面的代表性显微镜图像。比例尺:200μm。#:通道的横截面。黑色箭头:新形成的组织。黄色箭头:新形成的毛细血管。C)皮下植入2和4周后,不同支架内组织生长的半定量表征。(n≥5,*p<0.05,**p<0.001,NS:不显著)。D) 对vWF(绿色)和DAPI(蓝色)进行免疫荧光染色后,新血管形成的外植体截面(Da-i至Dc-i)的代表性荧光图像。炎症性巨噬细胞(Da-ii至Dc-ii)在免疫荧光染色iNOS(红色)和DAPI(蓝色)标记后,以及抗炎性巨噬细胞(Da-iii至Dc-iii)在免疫荧光染色CD206(绿色)和DAPI(蓝色)标记后。比例尺。100 μm。 #:通道的横切面。黄色箭头:新形成的毛细血管。
最后,作者指出,PEC生物墨水和Pluronic F127支持基质在嵌入式3D打印中的优化组合可以确定几个相关的创新,包括1)在高打印分辨率下形成复杂的多层结构,2)相对较低的规模化障碍,以及3)制造过程中强大的容错性。分层通道网络在体外和体内表现出良好的通畅性,能促进质量交换以维持高细胞活力,并在皮下植入后促进组织再生和整合。这样的孔道支架将大大有利于生理相关组织的形成,可以用于体外测试组织模型或体内重建手术。

来源:BioactMater生物活性材料


