您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-01 12:38
概述
低剂量药物一般是指药物规格很低、载药量极低的药物。关于低剂量药物的限度,不同的国家有不同的规定。美国药典将载药量在1%以下的药物定义为低剂量药物,而英国药典则将低于2mg或载药量小于2%的制剂定为低剂量制剂。有中国的审评专家认为,目前较为公认标准是将规格低于1mg的药物定义为低剂量药物。表1中列出一些不同剂型的低剂量口服药物,其中规格最低可达到0.25μg。
这些药物活性高,规格极小,为了实现日常口服的可能性,制剂成品中辅料占比极高。这造成了这类药物的处方工艺开发、质量控制具有很大的挑战性。
表1 市售低剂量药物规格和处方实例
|
名称 |
规格 |
剂型 |
处方辅料 |
|
盐酸坦索罗辛 |
0.4mg |
胶囊 |
甲基丙烯酸共聚物、吐温80、SLS、微晶纤维素、硬脂酸钙 |
|
群多普利 |
1,2,4mg |
片剂 |
玉米淀粉、交联羧甲基纤维素钠、羟丙基甲基纤维素、氧化铁、乳糖、聚维酮、硬脂富马酸钠 |
|
醋酸去氨加压素 |
0.1mg、0.2mg |
片剂 |
乳糖、土豆淀粉、聚维酮,硬脂酸镁 |
|
骨化三醇 |
0.25、0.5μg |
软胶囊 |
部分三甘油酰椰油 |
低剂量药物的含量均匀度
低剂量药物的含量均匀度是其制剂工艺开发需要首先考虑的问题。在实际的制剂生产过程中,原辅料以粉末的形式混合,为了实现药物在各个制剂单位中的均匀分布,原料药分散单元必须足够小,即粒径必须足够小,但小粒径固体吸附性强,极易发生团聚,影响混合均匀,进而造成整个生产批次中可能出现含量超限,甚至含量极高的制剂样品。
在整个批次的样品中,这样的高含量制剂占比往往非常小,取样检测过程中被取到的概率也极小。另一方面,这些极高含量的样品仅仅会造成其他样品含量轻微下降,基本上不存在与这些高含量样品对应的极低含量样品。在制剂开发的实践中,除非大规模检测样品,常规的检测很难在实际检验中很难发现是否存高含量样品。即使在大规模成品检测中发现个别制剂单位含量限度极高,也难以判定这是由于样品污染还是样品本身的问题造成。这给确证生产工艺的可行性带来很大的难度。
其实药物都存在“卖出的药物都没有检验,检验的药物都没有卖出”的悖论。在制剂开发的伊始,从认知制剂特点及工艺风险,从设计上规避和控制风险,才是低剂量药物产品的质量的根本保证。
普通生产路线的考虑
(1)原料药的微粉化
低剂量药物单位制剂中药物含量低,辅料占比极高。原料药颗粒是药物在粉末中分布的基本单位,为了实现原料药粉末在粉末中的均匀分布,粒径足够小是基本要求。有人根据理论模型,计算了最终的制剂成品能够通过USP 905时,不同规格制剂对原料药粒径和粒径分布要求(见图1)。其结果表明,1mg规格制剂,若以99%的置信度通过USP 905,在d90/d50=5.91时,几何平均体积d50需要在10μm以下。这些理论计算的结果,可以作为粒径控制限度的起点。

图1. 规格与原料药粒径限度关系图(以99%的置信度通过USP 905)
在合成工艺中,大多数原料药颗粒通过结晶获得。若结晶所得固体粉末粒径过小,则可能产生过滤困难、残留溶剂难去除等问题。因此,大多数情况下,化学合成工艺所得的原料药的粒径及分布均难以满足低剂量药物制剂生产的需求,需要进行粒径减小的处理。常见的粒径处理手段包括,机械粉碎、气流粉碎等。在选择原料药的微粉化方法时,首先考虑是否可以达到所需的粒径尺度。常见的锤击式粉碎机一般可以将原料药粉碎至10~50μm,气流粉碎或者球磨一般可以达到10μm以下,当然具体的限度因原料药的性质和设备状况各有差异。除此之外,需要特别关注原料药的物理化学稳定性。
(2)原辅料混合
原料药的微粉化后步骤往往是与辅料的干混合,这一过程的难点在于“混不匀”和“测不准”。
微分化的API往往吸附作用较强,极易发生团聚,很难全部实现完全分散;某些原料药在混合过程受力容易再次结团,给混合带来了更大大难度。
混合过程,是同种粒子之间接触面断裂,形成空隙,其他粒子进入空隙,并形成新的接触面的过程。为了实现均匀混合,必须有足够的剪切力使原料药粒子相互分离,辅料颗粒才能有机会与原料药形成新的接触面;辅料与原料药形成的接触面的相互作用力,强度必须大于原料药颗粒之间,原料药与设备表面之间的作用力,混合均匀性才能随混合时间而增加。在混合设备方面,采用能够提供足够剪切力的设备,例如带有桨叶的混合设备,可以提供足够的剪切力;混合粉末采用多次过筛的方式,也是促进分散,避免团聚的方法;在辅料选择上,选用足够吸附力更强的辅料,减小粉末再次团聚的可能性。如果后续采用直压工艺,其中最为常用的是各种喷雾干燥所得的多孔直压型辅料,可以有效地吸附原料药粉末;在高剪切湿法制粒工艺中,常常采用一些粒径也很小的辅料,例如高目数的乳糖,提高辅料粒子和原料药粒子的结合力,在高剪切的作用下,能够很好地实现均匀混合,再通过加入粘合剂制粒,实现后续工序所需的流动性;在混合程序上,需要对物料加入顺序进行研究,加入梯度混合程序是提高混合效率的重要方式,先加入部分辅料,饱和仪器表面,可以有效降低其对原料药的吸附。
除去解决“混不匀”的问题之外,判断混合终点也是另外一个难点。中间体取样分析取样在证明混合均匀性上本身就存在局限性,低载药量的中间体粉末取样更容易受到取样过程和分析过程的影响,因此需要对取样方法(取样位置、取样量等)和分析方法(提取、检测方法等)进行详细的研究和确证。为了证明低剂量粉体的均匀混合,粉末的取样个数可能需要更多。除此之外,可以尝试采用在线检测的手段,但是粉末中原理药占比极低,对检测方法的精度要求也比较高。同时,采用成品生产过程中的分层取样验证粉末的均匀性也是十分必要的过程。
(3)生产过程中的原料药损失
低剂量药物的粒径必须足够小,这使得微粉化后的原料药极易吸附于设备表面,在生产转移过程中极易扬尘,这二者均能造成原料药在生产过程中的损失。但低规格原料药在混合粉末中的占比很小,这些原料药的损失可能造成制剂含量的显著下降。
从处方设计的角度,如果选择直压或直接填充的工艺,应当考虑选择吸附性更强的辅料,同时也需要注意原辅料的比例,充当主要吸附作用的填充剂应当能够提供足够的表面,以实现药物的完全吸附。在设备选择方面,提高批量、减小设备的相对表面积,可以减小设备表面吸附的影响。工艺上,减少物料的转移次数,能够减少工艺过程中的扬尘损失。采用定向混合(制粒)可以有效地减小设备吸附,后续工艺的扬尘,同也能规避压片或填充胶囊过程中可能出现的分层。
在一些容易产生气流的工艺中,例如高剪切湿法制粒、流化床制粒等,扬尘是造成的原料药损失主要原因。微粉后的原料药容易随气流富集在滤袋,甚至穿过滤袋。这种情况可以考虑过量投料以补偿原料药的损失。但在实际开发过程中,需要确证原料药的损失不是因为稳定性原因。
(4)生产中的其他考虑
低剂量药物一般活性非常高,随之而来的是更低的安全限度。一方面,操作人员允许的暴露量更低。很多低剂量药物的OEL(职业接触限值)等级都在4级及以上,需要采取特殊的防护措施,以保证操作人员的安全。另一方面,不同制剂品种中共线生产时,允许的残留限度也很小。这对设备的清洁方法和残留限度的检测提出了更高的要求。
其他工艺路线的选择
在实际过程中,很多原料药无法微粉化或者无法实现满足要求粒径,则需要采取其他制剂工艺。
很多原料药无法采取粉碎手段原因有多重考虑。第一,由于原料药本身的性质,例如,粘弹性较强或熔点极低的原料药很难粉碎。粉碎过程的本质是颗粒和设备表面碰撞或相互碰撞使颗粒破碎而粒径变小,很多熔点低的物质因碰撞过程中的产热而结块;第二,粉碎过程可能造成原料药产生不可接受的变化。例如有关物质增高、晶型转变等;第三,成本问题。低剂量由于活性高,生产环境控制往往比较苛刻,合成成本可能比普通药物更高。但是,药物的制剂生产一批所需的原料药量往往很小,工业化的粉碎设备的最小批量相对于制剂所需原料药过大,粉碎过程中的损失也较大。造成实际生产成本过高。第四,现有粉碎手段的达不到粒径要求。采用现有常规的粉碎手段,一般原料药的粉碎极限是几个微米。药物的规格越低,则要求更低的粒径,常规的粉碎后可能无法满足要求,那么粉碎后混合的工艺可能就不再适用了。很多文献中,可以采用原料药微粉化的规格限度确定为0.5mg。
针对无法微粉化的化合物,制剂策略的基本思路是通过溶解形成真溶液,增大处理对象的体积,再进一步考虑和辅料混合均匀和最终制剂成型的问题。
(1)溶解后制粒
将原料药溶于溶剂,根据原料药的稳定性可以选择水性溶剂或者非水溶剂。原料药溶解后,通过高剪切湿法制粒或流化床制剂实现原料药和辅料粉末的定向均匀混合获得含药的粒子;如果原料药具有成膜性能,也可以选择微丸包衣的手段。这些工艺路线的主要难点之一是晶型问题。溶剂挥发沉淀在辅料表面,形成的固体晶型是否可以保障制剂的质量是制剂开发中必须关注的问题。但低剂量制剂中原料药的极低占比,则让晶型的测定变得极为困难。
(2)固体分散体
实现药物溶解的另一种办法是将化合物与高分子材料互互溶。通常采用热熔挤出的方法,当然这种方法一般对化合物的热敏感性有一定要求。如果用于载药的高分子基质选择得当,化合物可以在高分子基质中实现分子级别的分散,呈现无定型状态,可以提高药物的溶出。此外,高分子基质可能对化合物分子有一定的保护作用,可能会改善化合物的稳定性。一般情况下,热熔挤出的复合材料一般体积较大的固体,需要进一步粉碎成粉末,再用于后续工序。
(3)复合物
增大化合物的体积更为直接的方式是直接形成复合物,最为常见的选择对象便是环糊精。环糊精的环形分子结构构成了一个疏水腔体,腔体外围存在大量的亲水基团,使其具有非常好的水溶性。环糊精可以和化合物的疏水部分结合,进而形成复合物,提高化合物在水中的溶解度。相对于原始的低剂量原料药,形成复合物后体积明显增大,便于后续工序的设计。与采用热熔挤出类似,环糊精复合物也兼具增溶和提高稳定性的效果。
(4)软胶囊
开发低规格制剂另外一个重要的策略是,避免固体粉末的处理,选择开发为溶液剂型,这不但可以实现制剂成品的含量均匀度,也能够避免固体制剂中常见的扬尘问题,减小操作者的暴露风险。考虑到病人使用的便利性,软胶囊无疑是最佳的选择。选择软胶囊开发可以选择疏水性的液体油溶剂,也可以避免因为固体制剂中的水分引起的稳定性问题。
总结
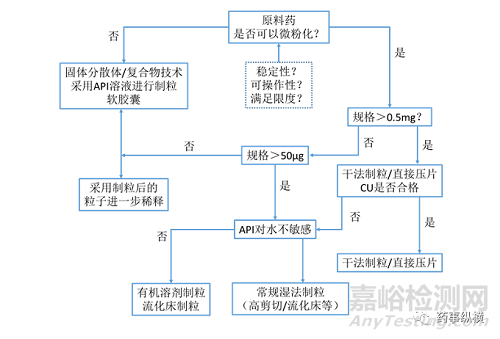
图2. 低剂量药物工艺路线的决策树
与普通产品的工艺开发过程类似,低剂量的制剂工艺路线的选择的基础也是原料药的理化性质。同时,基于不同的原因,工艺路线的选择也呈现多样化。图2提供了一个工艺路线选择决策树。其考虑的关键因素主要包括原料药的微粉化和原料药的稳定性。但另一方面,工艺路线的选择也受到可选生产技术平台的限制。一般而言,常规直压和干法/湿法制粒路线所需的设备较为常见,可以是首先考虑工艺路线。如果条件允许,基于一些特殊的制剂技术平台,例如软胶囊,进行低规格制剂的开发,可以获得独特的优势。
(注:本文系笔者根据相关资料和自身经验整理总结所得,鉴于水平有限,难免存在谬误疏漏之处,还请读者谅解并不吝赐教。)
参考文献
1.章俊麟,何伍,低剂量固体药物制剂的质量控制要点,中国医药工业杂志2016, 47(12),1604-1608;
2.JackZhang,Formulation and Analytical Development for Low-Dose Oral Drug Product;
3.Chien-Yueh Huang, M. Sherry Ku, Prediction of drug particle size and contentuniformity in low-dose solid dosage forms,InternationalJournal of Pharmaceutics, 383 (2010) 70–80;
4.BRIAN R. ROHRS et. al, Particle Size Limits to Meet USP Content UniformityCriteria for Tablets and Capsules,JOURNALOF PHARMACEUTICAL SCIENCES, 95 (2006) 1049-1059;
5.Methodology of oral formulation selection in the pharmaceutical industry,EuropeanJournal of Pharmaceutical Science 87 (2016)136-163;
6.梅希,小剂量药物质量研究时的几点经验,药事纵横。

来源:Internet


