您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2021-07-17 21:49
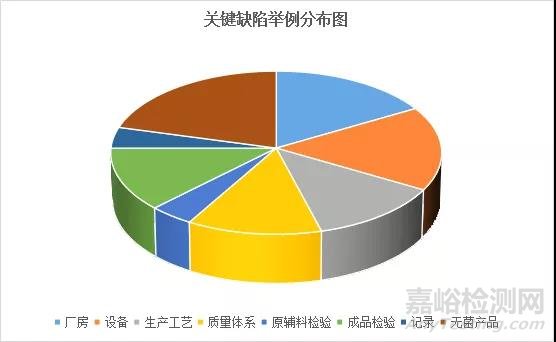
2021年5月28国家药监局发布《药品检查管理办法(试行)》,对境内上市药品的生产、经营、使用环节实施的检查、调查、取证、处置等行为进行了规定。其中明确要求对药品生产企业的检查依据2014年5月颁布的《药品生产现场检查风险评定指导原则》(下称指导原则)确定缺陷的风险等级,并规定以下情形不予通过:a.对使用者造成危害或者存在健康风险;b.与GMP要求有严重偏离,给产品质量带来严重风险;c.有编造生产、检验记录,药品生产过程控制、质量控制的记录和数据不真实;d.发现严重缺陷或者多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。与之呼应的是在《指导原则》中也明确严重缺陷包括以下四种情况:a.对使用者造成危害或存在健康风险;b.与药品GMP要求有严重偏离,给产品质量带来严重风险;c.有文件、数据、记录等不真实的欺骗行为;d.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。该指导原则同时对严重缺陷进行部分举例,若以关键缺陷举例情况分布饼图如下,可知关键缺陷分布在八个大项中,其中记录和数据不真实举例出现在四个大项中,占比50%。该指导原则中所有关键缺陷、主要缺陷和一般缺陷合计132项,但只要出现“伪造/篡改记录或不如实进行记录”字样的缺陷全部出现在关键缺陷中。
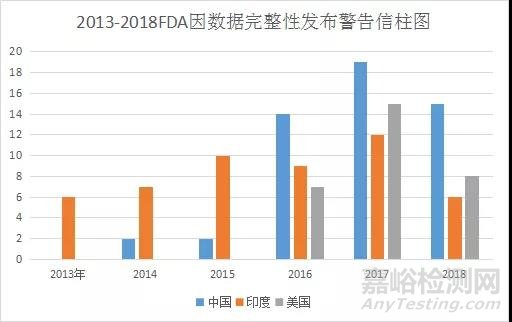
上述规定是药品管理法第七条中保证全过程信息真实、准确、完整和可追溯的法律规定的执行细则,它们也说明了中国NMPA对记录和数据不真实的持续高压和一票否决决心,与欧美药监系统的理念如出一辙。FDA2013至2018年度因数据完整性开出的警告信见下图。换句话说,一旦GMP体系中出现了假记录,如论如何解释都是苍白无力的。
有关数据完整性的问题,许多同行和官员以及学者都从不同角度进行过详尽讨论,今天笔者打算从实际参与迎检的角度探讨记录和数据不真实的一些情况,期望与读者能分享心得体会,避免踏入别人掉过的坑里。
一、水系统检测问题
现在各药品生产企业的产品基本是国内外双报或多报,故对制药用水纯化水、注射用水、灭菌注射用水控制要求同时满足中国药典(Ch.P)、欧洲药典EP和美国药典USP等。以纯化水为例,Ch.P控制性状、酸碱度、硝酸盐、亚硝酸盐、氨、电导率、总有机碳或易氧化物、不挥发物、重金属、微生物限度指标。USP主要控制关键三个指标总有机碳、电导率和微生物限度;EP测试项目为微生物、总有机碳或易氧化物、电导率、外观、硝酸盐、铝和内毒素等,对于分装在容器中的纯化水,增加酸碱度、盐酸盐、硫酸盐、氨、钙镁和蒸发残渣项目。纯化水测试相对来说不复杂,只要配备足够有资质的人员花时间去测试即可,但有一些需要注意的坑。
1.Ch.P的不挥发物和EP的蒸发残渣的测试。方法是取纯化水100ml在100-105℃下蒸干至恒重,本项目的问题点在恒重上。绝大部分公司分析记录上均两次恒重的数据,极少数不恒重需要进行第三次称量的,有打印纸上的重量为证。试想纯化水验证期和日常监测动则几百上千个水样品需要测试,极少或基本没有称量第三次的情况,有经验的或有实战经历的审计官是不信的。建议感兴趣的同行可仔细向测试部门专业人士了解详情。
2.试剂的平衡。大多数化验室的试剂管理由化验室专人对进入化验室的试剂进行品名、数量、级别等信息进行登记,然后贴上开瓶日期、使用期限等标签。药品生产企业有一个纯化水系统十几个使用点算少的,稍微上规模企业好几个纯化水系统、甚至同时存在注射用水、灭菌注射用水系统均需要测试,这样会消耗相当数量的分析试剂,如:盐酸、硫酸、碱性碘化汞钾、对氨基苯甲酰胺、氯化钾等试剂。纯化水系统验证下来加日常监测水样品数量上百上千甚至上万,它们被测试所使用的试剂重量与采购进入化验室的量应平衡,即对纯化水测试而言,因化验室使用有损耗,进入化验室的所用试剂总量应大于等于纯化水测试用试剂总量。一些工厂对每瓶试剂或试液的使用有台账的,试剂平衡难度更大。官方检查组中通常有一位是分析背景的,若粗略一算有疑点,那试剂平衡就要接受考验了。笔者见过某公司纯化水系统全验证测试样品量约1480个,仅测试硝酸盐至少应使用500ml硫酸15瓶,但其化验室从仓库领用硫酸的记录上累计10瓶不到,进一步查其易制毒试剂记录上显示为7瓶,后来该公司无法证明纯化水系统测试记录是真实的,最终该公司GMP现场检查不通过。
3.微生物测试。该项目测试从技术上讲不难,但涉及相当多重复的工作,比如:用具用品灭菌和消毒、培养基配制和促生长实验、菌种传递、样品制备,培养,菌落计数等等。微生物测试的难点为实实在在、按部就班去做和如实的记录,我们不能认为其没有难度而不注重微生物测试的细节和真实性。FDA警告信中微生物测试问题并不少见,如:2015年12月海正药业收到的警告信中称“2015年3月2日,FDA调查员发现在6#培养箱中的所有14个培养皿已经干裂,这将会影响微生物促生长和准确计数,进而影响数批原料药的检验结果”。2018年2月FDA给印度Alchymars ICM SM Private Limited警告信也说到“我们的调查员发现在XX水使用点检验中,在XX平板上发现的菌落形成单位(CFU)的数量与XX水报告上记录的数量有显著差异。对于多个使用点,你们的分析员报告的CFU远低于我们调查员在平板上观察到的CFU”。另一方面,微生物测试用到的一些仪器比如:生化培养箱、霉菌培养箱、对照培养基和菌种储存用的冰箱、冰柜等在仪器确认过程中常被发现不能达到验证的可接受标准。因此药企在采购前应从同行或供应商处调研采购药用或能真正通过确认的仪器设备。笔者在工作中遇到过上海某企业的生化培养箱和某大品牌家用冰箱,在仪器确认中如论如何也达不到规定使用范围的可接受限度,浪费了时间人力物力,更重要的是有经验的检查官深究能抓到小辫子哦。
另外与纯化水系统有关的其它细节如时间先后顺序、容易遗漏问题也需要注意。如:国家药监局核查中心2016年7月查出长春博奥生化药业有限公司7月22日对纯化水三个使用点取样检测,实际微生物检验应在7月27日完成,但7月26日企业即提供了合格的检验报告。又如某公司在TGA检查时被发现,2017年5月产品生产中用到纯化水检测报告均合格,但纯化水系统上在线TOC记录仪存储的记录显示5月17日13时开始TOC数据不合格,直到5月25日才恢复正常,电子数据与书面记录及报告不一致。
二、生产记录
国家药监局官网已公布检查中发现国内31家公司批生产记录不真实,采取了收回GMP证书,并依法调查处理。生产记录作为证明药品生产的证据,是GMP现场必然检查的资料之一。根据国家局公布的情况,典型的生产记录不真实的情况以下几类:
1. 倒卖的或生产时没有做记录。如:国家审评查验中心抽查中药饮片党参(批号161201)、牛膝(批号161201)的批生产、检验记录,在质管部发现QA人员正在编写以上两个品种的批生产、检验记录;企业无法提供所生产的中药饮片黄芪(批号161001)、菊花(批号161001)、山银花(批号161001)、酸枣仁(批号161001)、制何首乌(批号161001)、大枣(批号161001)、当归(批号161001)、黄连(批号161001)、甘草(批号161001)的批生产、检验记录等;
2. 物料不平衡,国家审评查验中心检查时通过查物料采购发票和进出库台账很容易查出来。如:如柠檬酸(进厂编号Y09-131101)购进15000kg,批生产记录显示,用于生产枸橼酸铁铵(批号1311004、1311005、1311006、1311007、1311008、1312001、1312002、1312003、1312004、1312005、1312006、1312007、1402001、1402002、1402003、1402004、C03140601)17批,使用该批柠檬酸19800kg,记录使用量大于购入量;该公司被查到2014年以来奥拉西坦原料药的销售量、使用量、库存量较批记录显示的生产量多出53693kg;企业部分批次万应胶囊批生产记录中使用的万应药粉批次,与其生产车间办公电脑中保存的药粉入库使用情况文件不一致。
3. 生产记录和设备以及辅助记录等相互矛盾。如炒药机(编码03040501)实际加工当归的能力为每次70kg左右,而记录的是一次加工完104kg;实际加工甘草的能力为每次80kg左右,而记录的是一次加工完105kg;生产过程中洁净区存在关闭空调系统的情形;
4. 记录中签名字迹与操作人员本人笔记不同。如:对羟基苯甲酸乙酯物料进出台账(2017年3月21日至4月24日)与乙醇货位卡(2018年3月4日至29日)中两位记录人的签名前后不一致;批生产记录中相关工序涉及有关人员的签名存在代写情况,如桂枝(批号:20160516)、紫草(批号:20160601、20160321)批生产记录中部分人员的签名;
5. 人员操作在时间或空间上相互矛盾。如:同一人同一时间段在不同车间进行操作;如化验室主任周某于2015年2月26日入职该企业,但20150210批次乳香的《原药材检验报告书》显示周某在2015年2月13日签发,与入职时间明显不符。灭菌操作工现已经离职(企业未能提供其离职报告),经与该员工电话确认,其表示于2017年5月15日或5月16日离职,但5月16日至该月月底仍有7批三七细分批生产记录(Q-170503至Q-170509),6月份有5批(Q-170601至Q-170605)三七细分批生产记录显示有该员工进行灭菌操作;11月11日生产批号为151101黄芩浸膏粉时,批生产记录中操作人员的签字显示操作人员李华当天下午4点上班,到第二天(11月12日)早上2:45一直在班,而企业考勤表上显示该人员于11月11日上午7:52进厂、11:30出厂,下午13:45进厂、19:30分出厂。
6. 批生产记录仅为应付检查用,明一份暗一份。2015至2016年,炎可宁片生产时填写两份批生产记录,其中一份为实际生产记录,其记录的处方、工艺与国家标准不一致;另一份为编造记录,其记录的处方、工艺与国家标准一致;移交批号为20170201的对羟基苯甲酸乙酯于2017年7月4日取样90克,但在货位卡无相应记录;氨咖黄敏胶囊(批号:151101、151102、151201)批生产记录不真实,不能反映配料、混合、粉碎、制微丸、干燥、整粒的实际生产过程,批记录中填写的数据与实际生产过程的数据不一致;复方冬凌草含片生产工艺规程中规定批量为150万片时,投料量为处方量的1500倍。但实际生产过程中,企业按照处方量的4500倍进行投料,生产出浸膏后,将浸膏分成三份,按每批150万片投料进行含片生产;中药饮片菟丝子生产加工无批生产记录,提供的批生产记录为后续补充完成等等。
以上6类是药品生产企业明显违反GMP的证据,相信绝对多数企业已经能杜绝这种明显的数据完整性问题。生产质量体系已经有效运行5年以上的药品生产企业应考虑是如何科学的完成生产记录,避免因为没有有效管理生产记录而掉进数据完整性的坑,即不要被误伤。生产记录中常见的误伤情况。
1. 批生产记录中时间、温度、压力、数量等的数值让人产生联想,0到9十个数字中某几个出现的频率超乎寻常。正常而言它们出现在结尾的次数几率几乎一样的,当然因仪表显示或称量最小刻度限制的合理情况不属于这个范畴。如:0,5,6,7,8结尾的数值明显比其他的数值多(注:因批生产记录涉及隐私,图样不再附上)。
2. 生产记录中投料量基本都是生产指令单上的准确值。比如某上市公司生产指令单上投料主料300.0kg,溶剂A783.5kg,溶剂B205.5kg,试剂A17.2kg,试剂B418.3kg,饮用水2100.0kg,批生产记录上分别对应的是:300.0kg,783.5kg,205.5kg,17.2kg,2100.0kg。通常一个公司在物料的称量上或计量上有明确规定,比如关键配比的需要准确称量的一定按照指令单投料,若辅料多少重量范围内允许误差多少以及如何动态的记录物料称量过程。如:上述公司批记录中水析结晶的饮用水2100.0kg,让检查官有不少疑问:用什么计量的,流量计还是磅秤?一次性称量的还是几次称量的,几次称量的每次的毛重和皮重呢?为什么这么准确2100.0kg,不多也不少,若不是水而是挥发性强酸或粘度比较大的物料呢,等等。笔者在江苏某药厂见过检查员挑战投料量上吨的总是准确称量投料的场景。
3. 长时间保温或干燥时,时间和温度的尾数基本保持不变的。如:某原料药公司批生产记录中保温15小时记录上的数值:05:50,37.0℃,06:07,45.6℃,07:07,45.6℃,08:07,45.6℃,09:07,45.6℃,10:07,45.6℃,11:07,45.6℃,12:07,45.5℃,13:07,45.6℃,14:07,45.6℃,15:07,45.6℃,16:07,45.6℃,17:07,45.6℃,18:07,45.6℃,19:07,45.5℃,20:07,45.6℃,21:07,45.6℃。每小时记录时间控制的很严格都是07分钟,温度仅两个时间点相差0.1℃,其余均45.6℃。有生产经验的检查官大概率是有疑惑的,哪个公司生产的不锈钢反应釜,温度波动如此小如何达到的?记录的时候会不会差一两分钟呢,等等。反正笔者是不相信长时间反应釜保温和烘箱干燥记录时间和温度控制的太好的。
4.生产称量记录中桶装物料毛重基本一致,且前一天剩下物料第二天称量几乎不发生变化的。某公司生产指令单上要求甲醇投料252.0kg,物料称量复核记录:5月11日03-1905003批产品中甲醇投料记录182.0kg-10.2kg,82.0kg-101.6kg;5月12日03-1905004批投料记录101.6kg-10.2kg,182.0kg-21.2kg;5月13日03-1905005批投料记录1.2kg-10.2kg,182.0kg-10.2kg,182.0kg-101.8kg;5月14日03-1905006批投料记录101.8kg-10.2kg,182.0kg-21.8kg,.....这里的问题是空桶重量可能差不多,但供应商来的或自己分装的每桶甲醇真都是182.0kg吗?连续三天的甲醇桶皮重投料前称量真能同前一天留下来的皮重一样吗?
5. 批生产记录中年、月、日修改多处,不符合常理的。某公司A成品11-19071批生产记录中两处时间有修改,20/07/23用双横线划去修改成19/07/23,原来的20/07/23仍清晰可见。同时11-19086批生产记录中的保温日期19/10/08改成19/11/23。年月日的修改大多会出现在年初、月初出于习惯,如2020年1月2日笔误写了2019开头,月初类似。在常理下不会出现年中或月中二、三次的年月的修改,这样记录会被检查官重点关注。
另外,对于同时期的批生产记录纸张颜色一致性、同一批号记录中受控号颜色一致性、同一人笔迹一致等等细节不在累述。总之,生产记录作为产品质量追溯最重要的记录之一,企业需通过培训、管理、考核等手段,实现生产记录符合数据完整性ALCOA要求,避免节外生枝,小失误造成关键缺陷。
三、化验室的偏差
2013年至2019年FDA以化验室为突破口检查到的数据完整性问题导致483缺陷乃至警告信比比皆是。随着行业内对数据完整性问题的重视,各企业从软件和硬件着手确实降低了其引发关键缺陷的风险,我们从前文数据完整性涉及的警告信图也可以看出。
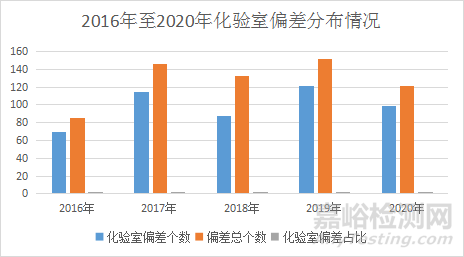
化验室数据完整性问题的解决使药品生产企业的数据暴露在阳光下面,也引发了新的问题即化验室偏差(含异常数据和OOS)集中爆发。某药企化验室HPLC和GC在2016年4月投入使用网络版服务器,该化验室2016年至2020年偏差数和企业总偏差数以及占比分别为2016年69/85/81.2%,2017年114/146/78.1%,2018年87/132/66.0%,2019年121/152/79.6%,2020年99/121/81.7%,其化验室偏差分布情况图见下。从统计数据来看,自从网络版服务器投入使用后,化验室的偏差(含异常数据和OOS)在全公司的偏差中占比基本在6-8成,在各部门偏差分布中显得一枝独秀。笔者通过与同行交流和对检查企业的统计,发现不同药企的化验室偏差占比有高有低,但几乎都是占第一名的。
FDA显然注意到这个新问题的出现,他们随机抽取了一批美国药企对化验室偏差率进行了统计,发现一般药企化验室和高水平药企化验室的偏差率有显著不同。一般药企化验室偏差率为20.6%,而高水平药企的为6.4%。FDA开始关注药企的偏差处理情况,检查化验室偏差和OOS的根本原因调查。因此,不少有关偏差和OOS调查的483缺陷被公布出来。比如:对不能解释的不符合项没有进行彻底调查。其二年共发生139起OOS,其中134条判为无效OOS,却未发起全面调查追溯可能的生产原因和历史批次的类似情况。公司OOS和OOT调查不充分,只是采用了复测合格结果,把原来不合格结果判为无效而没有调查原来不合格结果的根本原因。再如:某USP规格API的HPLC含量测试OOS,基于以下事实,化验室判定最初测试结果无效。—样品和标准品分析溶液在分析操作和确认分析结果前就被丢弃;—样品和制备标准品超过了溶液稳定性期限。国内药企目前存在共性的问题:化验室偏差(含异常数据和OOS)偏多,大比例的无效OOS;偏差发生中人为错误比例高,反复发生;偏差的整改措施基本是培训和修订SOP。笔者检查过的药企,其中两个典型偏差调查出的根本原因分别是“工作不严谨,强调工作认真仔细”和“XXX工作不认真,在放置样品瓶时误将XX批杂质样品溶液放在了标准品…”。而这里两个偏差的整改措施均是对相关人员进行SOPXX的再培训和考核,跟进后续情况。姑且不说调查出来的究竟是不是根本原因,仅就整改都是培训而言,这样可能会收到警告信的。如FDA在2017年11月6日出具了这样的警告信:“化验室CAPA经常性仅限于再培训,而不关注仪器、分析方法的优化提升,也没有涉及生产调查”。那么问题来了,我们该如何进行化验室的偏差的根本原因调查,避免掉入坑里呢?
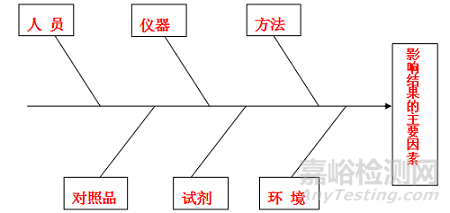
化验室偏差从以下鱼骨图中的人员、仪器、方法、对照品、试剂和环境等六个主要方面展开调查,找到根本原因,经影响评估后制定纠正预防措施并实施,最终避免发生类似的偏差。
各药企的同行对偏差调查已相当的精通,本文不在累述。在这里编者想重点讨论化验室反复出现的人为错误及其根本原因的深究。
根据国内外知名GMP咨询公司的思路,现对人为错误进行剖析和分类,同时在分类中进行细解,抛砖引玉,引导对原因刨根问底,以期真正解决问题。
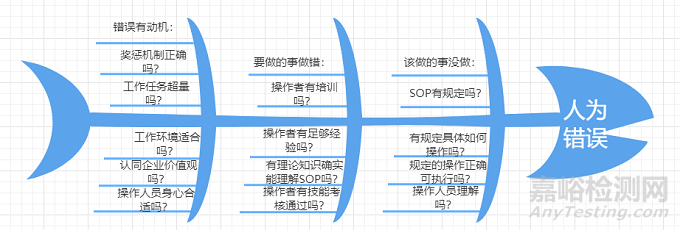
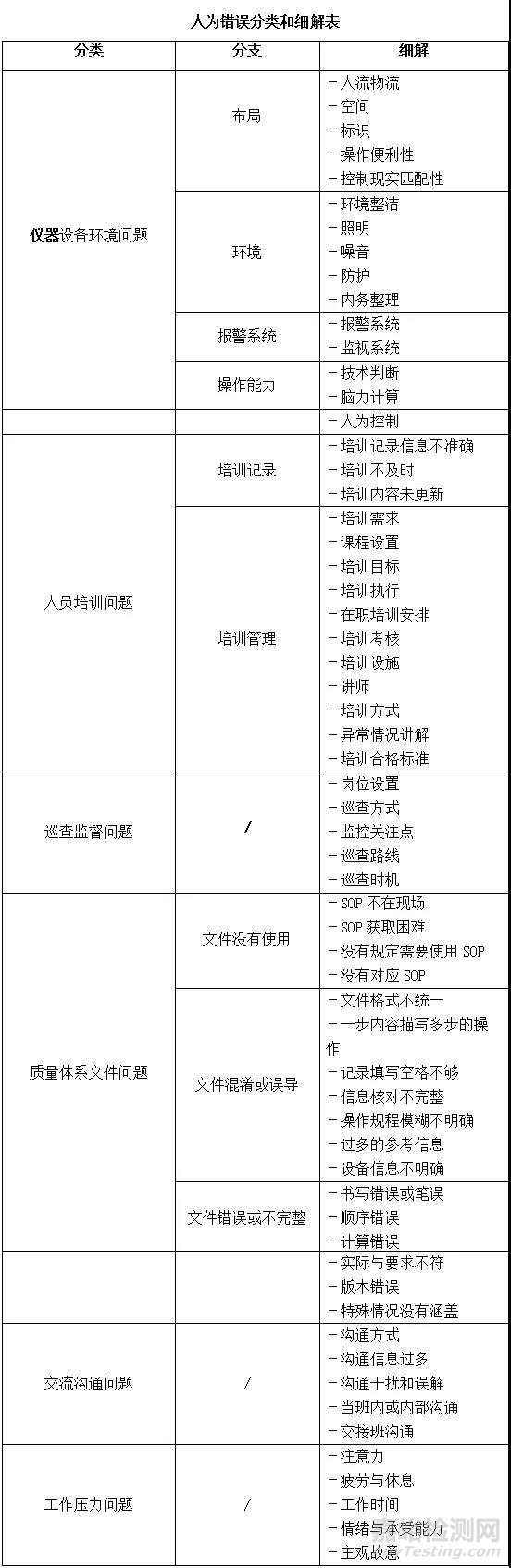
感兴趣的读者或同行可针对化验室的偏差(含异常数据或OOS)按照以上剖析和分类细节表中的内容举一反三,从深层次寻找产生重复性偏差的根本原因。从而在企业文化和管理层面着手去真正解决问题,避免掉入调查能力不足的坑里。
结语
纵观国内外药品监管机构对制药行业的政策引导趋势,不难看出决策者们均有清晰策略和方向。
以FDA为例:
FDA现场检查关注点→物料交叉污染→数据完整性→调查能力→工艺可靠性
如今作为制药企中的管理者们应真正理解政策的真谛,将安全环保合法合规作为底线,质量体系建设和有效运行当标准配置,从产品立项和研发第一步就把事情做好,在药品生命周期管理中不重蹈覆辙,趟别人掉过的坑。企业在发展的道路上才能越走越宽,越走越远。

来源:药事纵横


