您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-09 18:10
生物类似药可提高患者对于高品质生物治疗药物的可及性,各国政府和监管机构均鼓励其研发。生物治疗药物一般由微生物或者细胞表达后纯化而来,由于结构复杂,生物类似药的研发过程和监管均不同于化学仿制药。本文对国内外生物类似药的研究概况进行介绍,并对我国和国际上主要国家地区生物类似药法规和指南的差异进行了比较。药学相似性研究是支持生物类似药研发的基石,本文通过实例阐述了药学相似性研究的重点与难点,并对临床研究结果和关注点以及适应证外推等问题结合案例进行讨论。多个生物类似药在我国将陆续完成研发申报上市,期望本文为相关研发企业及监管机构提供一定的参考作用。
近年来,随着全球销售额超过10亿美元的多个“重磅炸弹”级原研(参照)生物药专利保护到期,生物类似药的研发呈现井喷的态势。为了更好促进生物类似药的发展,各国监管机构也在逐步建立并健全相关技术指南。由于各国监管方式及监管理念不同,生物类似药的研发进展存在明显差异。
我国已经对各类生物类似药的研发进行了巨大的投入,研发的品种和参与研发的企业数量为全球最多。在借鉴国外成功案例的同时,我国也根据自身的经验总结出一条适合我们的发展道路,使得我国生物类似药临床研究的效率不断提高,这对于增加治疗药物的可及性、加快解决人民健康需求具有重要意义。本文将从国内外生物类似药的研发概况、各地区生物类似药相关法规和指南的对比、临床前药学质量研究、临床研究的结果评估和面临的困难及适应证外推等5个方面综合描述生物类似药的研究进展及生物类似药研究所面临的挑战。
1、 国内外生物类似药的研发概况
生物类似药的名称和定义在国际上并未完全统一(表1),我国将生物类似药定义为在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。欧洲是最早发展生物类似药的地区,欧洲药品管理局(EMA)于2004年发布的《生物类似药指南(草案)》,为生物类似药发展奠定了坚实的基础。随后EMA又陆续针对粒细胞集落刺激因子、胰岛素、人生长激素、重组促红细胞生成素、小分子肝素、重组人干扰素α、重组人干扰素β、促卵泡素、单克隆抗体等9个细分领域出台了相应的指导原则,形成了目前最完善的生物类似药审批和监管体系,为全球生物类似药发展提供了宝贵的经验。自2006年EMA批准了全球第1个生物类似药以来,随着大批重磅生物药专利保护相继到期,生物类似药的发展进入快车道。迄今为止EMA共批准了68 个生物类似药,其中单抗类似药30个(见表2)。2009年美国通过《生物制品价格竞争和创新法案》,截至目前,美国FDA共批准了28个生物类似药,其中单抗类药物最多(19个,见表3)。目前我国的生物药物研究还处于初级阶段,研发生物类似药的难度相对新药较低,由仿制药过渡到创新药会更好地促进我国生物医药的发展。2015年2月,我国由国家药品监督管理局药品审评中心(CDE)发布了《生物类似药研发与评价技术指导原则(试行)》,至此我国建立了生物类似药评价管理工作的基本原则。2019年2月首个国产生物类似药—利妥昔单抗注射液(汉利康)获国家药品监督管理局(NMPA)批准上市,填补了我国生物类似药领域的空白,截至2020年7月,我国已上市4种共6个生物类似药(见表4),在研究生物类似药项目的靶点主要集中在血管内皮生长因子(vascular endothelialgrowth factor,VEGF)、人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2)、CD20、肿瘤坏死因子α(tumornecrosisfactorα,TNF-α),见表5。

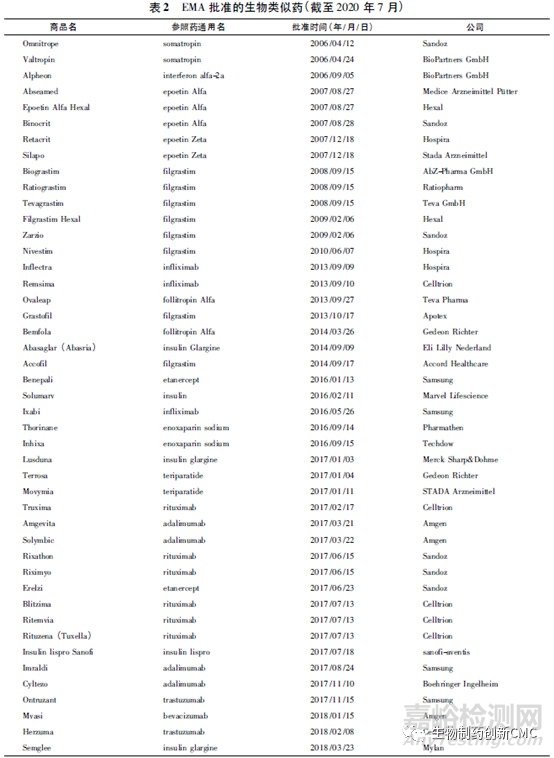
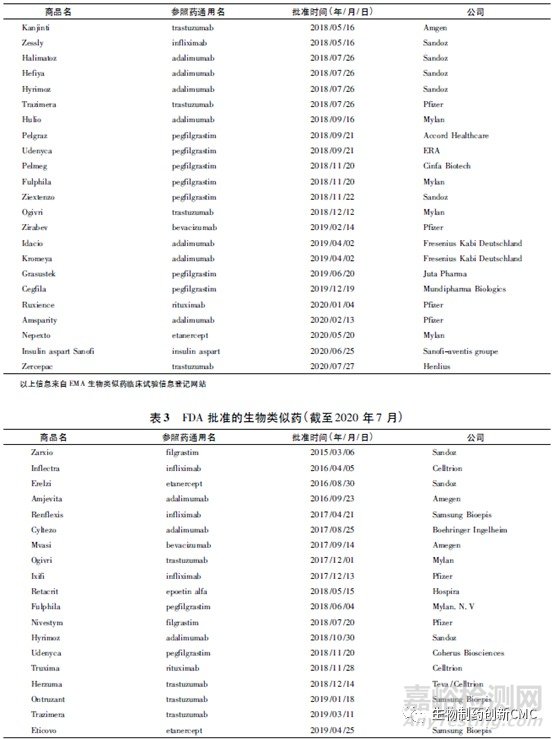
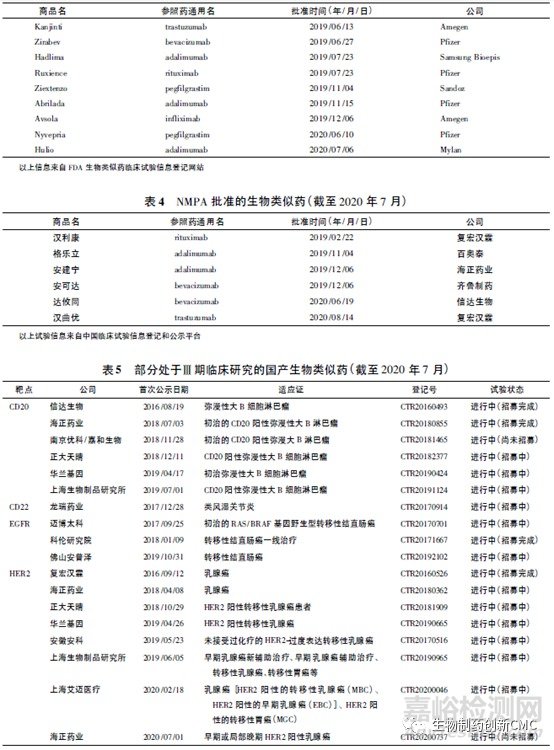
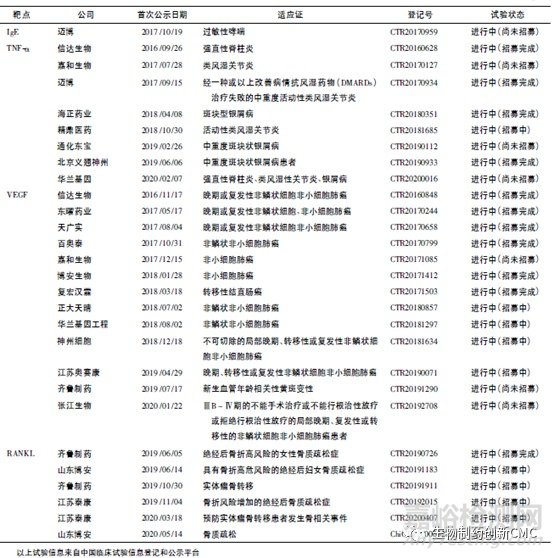
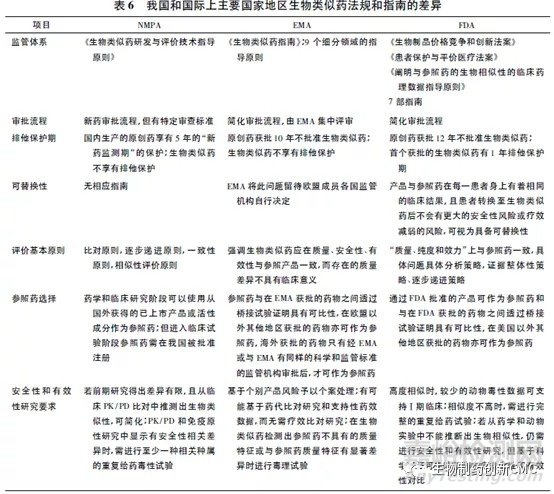
2 、生物类似药相关法规和指南的对比
2004年欧洲EMA发布了《生物类似药指南(草案)》。2009年美国国会通过的《生物制品价格竞争和创新法案》设立了具体的申请途径。2012年美国FDA制定了生物类似药在美国获批上市的基本要求框架,并于2014年出台了《阐明与参照药的生物相似性的临床药理数据指导原则》。我国借鉴世界各国的相关政策与法规,并结合国情,于2015年2月发布了《生物类似药研发与评价技术指导原则(试行)》。2016年7月颁布的《注册管理办法(修订稿)》,进一步规范了生物类似药的审评标准。
我国现有的生物类似药评价和监管体系,总体与其他国家类似,少数着重点和细节存在差异。表6对我国与欧盟、美国生物类似药的主要法规指南异同进行了比较和汇总。
3 、临床前药学质量研究
3.1 药学质量研究是生物类似药开发的重点与难点
药学质量研究是生物类似药开发的基础,候选类似药与参照药之间的药学(分析)相似性决定了非临床研究和临床研究的设计和规模。根据2015年NMPA 发布的《生物类似药研发与评价技术指导原则(试行)》,药学研究是非临床比对实验研究的基础。若前期药学比对实验显示候选类似药和参照药无差异或差异很小,则可仅开展药效动力学和免疫原性的临床比对试验。仅在体外药效、药代和免疫原性实验不能判定候选类似药和参照药相似的情况下,才需要进一步开展体内药效和毒性的临床比对试验研究。如前期研究结果可证明候选药与参照药之间无差异或差异很小,且临床药理学比对试验研究结果可以预测其临床终点的相似性,则可判断临床相似性。如前期药学研究不能判定相似性,应选择更加敏感的技术和方法,继续设计针对性的临床比对试验以证明其相似性。除NMPA外,其他国家/组织发布的生物类似药法规中也有产品的药学特性和参照药足够相似时才可相应减免临床试验的阐述。EMA在2014年发布的生物类似药法规中指出,当候选药和参照药的理化性质、生物活性、药效和药动学特征都具有相似性,且候选药包含的杂质和辅料都不会引起不良反应的情况下,可以免除临床试验。根据美国FDA发布的法规,当候选药与参照药在药学和人体药理的比对实验研究中表现出高度相似性,且通过了临床免疫原性评估,可评判二者的临床相似性。这就意味着,当全面的药学和体外比对实验证明候选药与参照药足够相似时,可以免除重复给药的毒性实验以及Ⅱ期临床试验。在此基础上,当临床药理实验也证明候选药与参照药足够相似时,可在不进行Ⅲ期临床比对试验的情况下确立临床相似性。综上,全面建立候选生物类似药和原研参照药的药学相似性,可以在缩短研发时间的同时大大降低开发成本。
由于生物药固有的微观不均一性,开发与参照药在药学水平高度相似的生物类似药产品的难度不亚于新药研发。生物药经由生物体、组织、细胞、体液等生产或制备,具有分子量大、结构复杂和存在多种翻译后修饰形式的特点。以单克隆抗体为例,潜在的修饰位点(糖基化、赖氨酸剪切、焦谷氨酸环化、天冬酰胺脱氨基及蛋氨酸氧化等)可能形成的变异体约有1×108之多,这些变体的组合在宏观上又表现为分子大小、电荷、糖谱等多种形式的变异体和纯度差异。这些变异体既有可能在细胞培养过程中由细胞活动产生,也可能是工艺操作的结果。例如糖基化和糖化修饰既能在细胞内部生物合成,也可能在产品暴露于还原糖中时发生化学反应形成。此外,某些贮存条件中或多或少存在一些降解途径,如氧化、脱氨或聚合。所有与产品相关的变异体都可能改变表达的重组蛋白的生物学特性,临床研究已经证实部分变异体会以各种不同形式影响疗效。因此,在生物类似药开发的过程中,需要对变异体进行鉴定、确定其相对水平,并将其控制在与参照药类似的程度上。有鉴于此,在生物类似药开发中,基于参照药进行反向工程的化学成分生产和控制(chemicalmanufacture and control,CMC)难度更甚于新药开发。
生物类似药的药学相似性要求对企业的生产工艺水平和检验方法开发提出了极大的挑战。生物类似药由制造过程中产生的各种活性物质的组成所定义,这些活性物质包括自身的分子变体、亚型或其他与产品相关的物质以及与生产过程相关的杂质。因此,生产工艺过程应适当设计,以实现根据参照药信息和表征所设定的目标药物质量概况(quality target productprofile,QTPP)。NMPA的法规指出候选生物类似药的生产工艺需根据产品特点设计,可以与参照药保持一致,尤其是工艺步骤的原理和先后顺序及中间过程控制的要求。然而,生物类似药开发企业通常无法获得参照药开发的相关信息,特别是生产工艺相关信息。因此一般情况下,生物类似药可根据其自身产品开发过程中所获得的信息来生产和控制,同时考虑生产过程的最新信息以及对产品特性的影响。在产品开发过程中,检测项目、过程控制和质量标准都来源于产品在工艺开发过程中的药学研究信息。因此,能够支持工艺开发且灵敏、可靠的药学研究检测方法显得尤为重要。采用先进的方法进行药物开发,加上质量风险管理和有效的质量体系,将有助于始终如一地生产高质量且与参照药高度相似的产品。
3.2 候选生物类似药与参照药的药学相似性分析
相似性研究的目的是为了确立参照药和生物类似药之间的相似性,同时排除参照药和生物类似药中可能存在的差异,以确认参照药所具备的安全性和有效性可以适用于生物类似药。药学相似性研究遵循相似性研究和评价的一般原则。通常情况下应采用同样的分析方法对生物类似药和参照药进行头对头比对,如有不适用头对头分析的情况(譬如某一样品中浓度过低等),需阐明具体原因。同时药学相似性分析也遵循逐步递进原则,在每项分析完成后,均应该评估生物相似性的不确定性程度,并确定下一个分析计划以解决不确定性。此外,药学相似性研究的实验设计需要足够敏感以发现生物类似药与参照药间的质量差异。对全面的药学比对实验研究观察到的任何质量属性差异的类型、性质和程度,都应该清楚地描述讨论和评估。对2种产品之间观察到的结构和功能差异的潜在临床效果也应进行评估,并在必要时通过动物实验或临床研究予以支持。
为了确立有效可靠的药学相似性,应选择足够多的有代表性参照药批次进行比对研究。为保障参照药批次的代表性,各国药监机构制定了相应的参照药产地、批次、效期的规定,给参照药的收集提出了严格要求。首先在参照药产地上,应采用相同产地来源的产品。在药学研究阶段,对于不能在同一产地获得的(如尚未注册上市的产品),也可以考虑其他合适的途径获得。例如,EMA允许采用非欧盟批准但遵循生物类似药法规和准则的市场上市的产品[ICH成员国的产品]进行药学比对研究。在批次数量上,FDA要求纳入至少10批次参照药与商业化生产和用于临床研究的6~10批次生物类似药进行平行比较,而EMA和NMPA的多批次要求相对笼统。此外,为了提供足够的代表性,FDA和EMA还要求尽可能选择效期跨越整个货架期的产品,并记录每个产品的效期以及进行各项比对实验时的具体日期。跨越效期产品的收集涉及漫长的过程,考虑到产品过期的问题,部分参照药需要在产品到期之前妥善冻存保管。如果通过冻存稳定性实验证明冻存不会影响产品质量,FDA可以接受将过期批次用于药学比对研究。
有效的药学比对分析实验依赖于可靠的分析方法和能力。药学相似性研究的分析方法虽然不需要经过全面验证,但所选用的方法需要被详细确认具有适当的敏感性和特异性,能够给生物类似药和参照药的相似性评价提供有意义的信息。此外对于分析方法本身的局限性也需要有正确认知。目前,先进方法已经可以满足生物药的全面表征需求,能灵敏检测到某些质量属性的微小差异。但是并非所有的质量属性都已经有足够灵敏和特异的方法能够区分候选生物类似药和参照药的差异。为了充分了解生物药的理化或生物活性,特别是关键质量属性(critical qualityattribute,CQA),常常需要采用不止一种的正交方法进行评估。比如同时采用体积排阻色谱和毛细管电泳分析分子大小异质体。正如ICHQ8(R2)所述,工艺开发中采用的先进检测方法可以更加精准地指导生产,更好地帮助候选生物类似药与参照药在各个方面进行匹配。此种策略可以进一步量化两个分子之间的整体相似性,并可能为后续的动物和/或临床研究提供更有选择性和针对性的参考信息。
药学比对研究设计依赖于对参照药和候选生物类似药的异质性详细了解,并参考ICH Q6B设置需比较的质量属性,评估每个质量特性与临床效果的相关性,设立判定相似性的评价标准。在生物类似药的质量比对研究中,FDA建议根据质量属性对临床的影响将其分成3个层级,采用不同的方法评价候选药与参照药的相似性(见表7)。EMA除了建议以参照药的质量上下限作为相似性区间之外,也倡导使用统计的方法分析生物类似药的质量可比性。例如,美国Amgen公司在美国和欧洲获批的生物类似药ABP501采用FDA推荐的3-Tier法进行了全面的药学相似性评价研究。研究中共使用24批美国获批的参照药,18批欧洲获批的参照药以及10批ABP501候选药。首先,详细列出了拟进行评价的质量属性及其研究方法,主要包括: 一级结构、高级结构、颗粒和聚体、产品相关杂质、热稳定性、一般特性、产品相关杂质及生物学活性等。然后,根据质量属性对安全性、有效性、免疫原性的潜在影响进行Tier风险分级及统计方法确定:①与作用机理相关的临床风险最高或与作用机理直接相关的质量属性分级为Tier 1,如可溶性TNFα结合活性,凋亡抑制活性;采用等效性检验法进行可比性评价,评价标准为:均值差值的90%置信区间处于等效界值(equivalence margin,EAC)范围内即为等效,等效界值取值为±1.5倍参照药标准差(±1.5SDR)。②对于临床风险相对较低的质量属性分级为Tier 2,如电荷变体、糖型、纯度及杂质含量、蛋白质含量、抗体依赖的细胞介导的细胞毒性作用(antibody-dependentcell-mediated cytotoxicity,ADCC)和补体依赖的细胞毒性(complement dependent cytotoxicity,CDC)活性等;采用控制范围法进行评价,评价标准为: 90%以上本品批次落在参照药控制范围内(Mean ± 3 SDR) 即为相似。③对于临床风险最低或不可量化的质量属性分级为Tier 3,如肽图、分子量、差示扫描量热法(differential scanning calorimeter,DSC)、热稳定性等;采用图谱对比法或描述法进行评价。最后,采用经过验证的分析方法进行全面的质量相似性评价研究,收集研究结果进行统计学分析,并结合风险分析结果确定研究结论。再例如,中国食品药品检定研究总院同样采用FDA推荐的3-Tier法对贝伐珠单抗生物类似药和相应参照药进行了全面的药学相似性评价研究,研究中共使用18批NMPA批准的参照药和10批相应候选药,结果显示候选生物类似药与参照药在药学方面高度相似。此外,对于采用多种方法评价同一质量属性的情况,可以将这些方法获得的结果分别归属于不同的层级。例如,相对偏差比较小的某些活性方法如基于报告基因法的ADCC检测方法,可以敏感地发现ADCC的微小变化,但基于报告基因法的测试并不能完全体现体内的活性,可选用更能代表体内活性的方法对ADCC进行同期评估,并且将最有代表性的方法赋予最高的层级,选用最严格的统计规则进行相似性评估,而通过其他方法测得的数据可以选用低层级对应的更宽松的统计规则进行相似性评估。

需要注意的是,生物类似药的相似性并不意味着所有的质量属性都必须相似,允许部分质量属性与参照药存在一定的差异,但需要充分评估该差异对临床安全性、有效性和免疫原性的影响。无临床意义的微小差异同样认为是相似的,如Amgen公司的ABP501的残留宿主蛋白和残留DNA含量均小于参照药修美乐,而唾液酸化糖型含量略高于参照药;此外,Celltrion公司开发的CT-P13与参照药类克在C末端赖氨酸变体含量上存在一定差异;三星公司的SB4与参照药恩利相比,在多聚体含量、疏水峰3杂质含量、O-糖基化修饰上存在一定差异;上海复宏汉霖的HLX01在赖氨酸变体和部分糖型上与参照药美罗华存在一定差异。
生物类似药的药学可比性研究是一个复杂的系统工程。在实际应用过程中,需要根据产品特性和质量属性特点等,进行系统、科学的可比性评价,并结合风险分析结果进行可比性判断。如果药学可比性研究存在不确定因素,在后续研究阶段还必须选择敏感的技术和方法设计有针对性的比对实验进行研究,并评价其影响。
4 、临床研究的结果评估和面临的问题
国家药品监督管理局药品审评中心在2015年2月颁布了《生物类似药研发与评价技术指导原则(试行)》。随后2年,药品审评中心针对主要的生物类似药种类分别召开了研讨会,并出台了相应的单品种的临床研究指导原则,如《贝伐珠生物类似药临床研究设计要点考虑(征求意见稿)》、《曲妥珠单抗生物类似药方案设计审评考虑要点(征求意见稿)》和《阿达木生物类似药临床研究设计要点考虑》。这些国外其他监管机构没有的单品种临床研究指导原则对我国生物类似药的临床研究具有巨大的指导作用。这些单品种指导原则对药动学比对研究和有效性比对研究中研究人群的选择、给药方案/剂量、研究终点、界值和样本量计算都做了比较详细的阐述和规定。这一系列的指导原则规范了临床研究的方案设计,促进了临床研究结果的良好评估。然而,临床研究仍然着面临一些难题。
4.1 原研参照药的选择
许多生物类似药管理指南均指出,在生物类似药与参照药的比较试验中所选的参照药必须被所在地区或国家相关部门批准。因此参照药的选择在不同国家存在差异,且生物类似药的获批尚无统一标准。对于生物类似药生产商来说,开发一种可以在全球商业化的生物类似药往往需要重新开展临床试验以获得不同地区的批准,这种重复试验造成了大量资源和时间的浪费。
4.2 研究设计
生物等效性研究最常用的研究设计是交叉设计,然而,由于生物类似药的半衰期往往比传统药物长得多,因此交叉设计通常是不可行的(较长的洗脱期)。此外,生物类似药产生免疫应答的可能性也限制了交叉设计的应用。例如,患者一旦在交叉设计研究的第1阶段产生了免疫反应,那么第2阶段治疗的疗效就会受到影响。
为了克服以上问题,在进行生物相似性研究时通常采用平行组设计。每个受试者只接受一种治疗方案,不需要洗脱期,这样就能减小患者产生免疫反应的潜在影响。然而,平行组设计可能有其他问题,例如样本量大小必须确保有足够的统计学意义来证明生物类似药和参照药之间的生物等效性,各变量在样本中的占比(如年龄、体重和性别)等。此外,平行试验设计限制了参照药和生物类似药之间互换治疗的外推。
虽然监管部门为临床比较试验提供了全面的指南,但即使是同一参照药的不同生物类似药,其临床开发策略之间也存在显著的差异性,具体包括效应终点、统计模型和纳入的样本量。医药生产商在研究设计上有着很大的灵活性,这是否会影响生物类似药的准确评估需要进一步探讨。
4.3 研究对象及给药方式
除了严谨的试验设计,为生物类似药的临床试验选择敏感的患者人群也至关重要。患者群体和短期临床终点需要足够敏感才能够检测出生物类似药和参照药之间潜在的任何可能的药物相关差异。
除了一些有明确严重不良反应的生物类似药,多数生物类似药的药动学/药效学(PK/PD)试验都在健康志愿者中开展。
虽然生物类似药管理指南建议单剂量给药,但实际试验中采用多剂量给药进行PK/PD评估也很常见。一般来说,如果单剂量试验因耐受性的原因不能在健康志愿者中进行,且在患者开展单剂量给药不可行,那么在患者中可进行多剂量试验。
4.4 评估免疫原性
对于接受生物制剂(包括生物类似药)治疗的患者,应该尽量在临床试验期间以及在药物上市后的监测阶段持续记录患者抗药物抗体(anti-drugantibody,ADAs)指标,特别是在免疫反应发生率很低,且在药物获批之前发生率难以确定的情况下。这对单抗等生物制品尤其重要,因为随着时间的推移,中和抗体的发生率具有不确定性。由于蛋白质的特性和生产过程的复杂(通常会引入杂质),事实上几乎所有的生物制剂都会诱发ADA;然而,不同产品和不同个体之间的发病率存在很大差异。大多数情况下,ADA没有临床意义,但高水平的ADA仍会干扰药物的PK和PD特性;少数情况下,生物制剂的免疫反应会引起严重的安全问题。因此,在研究过程中,相隔适当的时间采集样品进行ADA检测对于及时识别出有免疫反应的受试者尤为重要。对ADA进行有临床意义的比较评估是生物类似药开发的一项监管要求。然而,研究设计和免疫原性分析的方法仍然存在争议,ADA检测的可靠性很可能受目前有限的分析方法技术影响。此外,临床试验分析或动物数据不能准确预测人类的免疫反应,为了减少这一不可避免的风险,大量的真实世界数据将有助于理解生物制剂在不同人群中的长期安全性和有效性效果。
4.5 效应终点的选择
首先,在肿瘤学中,疗效常常通过临床研究中的无进展生存期(progressfreesurvival,PFS)和总生存期(overall survival,OS)来评估。然而,生物类似药与参照药的临床比较试验一般使用短期效应终点,如总缓解率(overallresponserate,ORR)或病理完全缓解(pathologic completeresponse,pCR),以实现降低成本、加速开发的目标。这些敏感终点必须与长期疗效终点[如无病生存期(disease freesurvival,DFS)或PFS]相关才能说明长期的生物等效性。
其次,效应终点的首选指标可能无法论证生物相似性,如PFS,DFS和OS,因为它们可能受到与生物类似药和参考单克隆抗体间的差异无关的因素影响,如肿瘤负担、性状和先前治疗。因此,一些生物类似药指南指出,替代终点(如整体反应率或肿瘤质量的变化)作为效应终点可能更加合适。
4.6 药物消除特征
经典的生物等效性研究通常用药物浓度-时间曲线下面积(AUC)和最大药物浓度(Cmax)分别代表总体暴露和吸收率,预设P 等效性区间为(0.80,1.25),如果几何最小二乘均值比率的90%置信区间完全落在(0.80,1.25)之间,则认为试验药品和参考药品是等效的。然而,目前EMA和FDA并未对生物类似药的等效区间作出明确规定,因此研究通常预设与经典等效性研究相同的等效区间。但由于生物类似药较长的半衰期和发生免疫反应(可能严重影响药物消除)的潜在可能,药物消除特征应在生物等效性研究中纳入考虑。事实上,目前EMA指南也指出“在生物类似药的比较试验中,PK的研究设计不一定必须要参照标准的‘临床可比性’的设计方案,因为吸收率/生物利用度的相似并不是唯一值得关注的参数,此外也应该考虑到产品间药物消除特征的差异(例如清除率和排除半衰期)”。
4.7 生物类似药与参照药之间的转换治疗
目前的证据表明,参照药与生物类似药在安全性、有效性或免疫原性之间的差异不会对转换治疗产生影响。然而,迄今为止进行转换治疗探索的临床试验数量有限。目前研究的主要局限有:①单向性。一般都是从参照药治疗转为生物类似药治疗,虽然由生物类似药转为参照药治疗的临床数据正在逐渐出现。②样本量小。③研究局限于特定的适应证。④缺乏适当的对照组。⑤现有数据以英夫利昔单抗生物类似药为主,研究的药物有限,且结果并不能推广到英夫利昔单抗的其他生物类似药或其他参照药的生物类似药。此外,由于第一次治疗后通常会评估疗效,因此转换治疗的研究可能无法用来评估疗效。上述转换治疗的研究目的多是评估安全性和免疫原性。Pires等认为需要进一步研究以探索治疗过程中从参照药到生物类似药的转换带来的影响。总之,目前关于生物类似药与参照药之间转换治疗的临床试验数据亟待补充。
4.8 临床研究评价的路径依赖
单品种临床研究设计要点考虑在很大程度方便了生物类似药研发企业的方案设计,也方便了监管机构的监管和统一的把控,但同时也造成了生物类似药临床研究评价的路径依赖(即Ⅰ期的药动学比对研究和Ⅲ期的有效性比对研究),而忽视了其他临床研究路径的可能性,比如《生物类似药研发与评价技术指导原则(试行)》中所述:“对前期研究结果证明候选药与参照药之间无差异或差异很小,且临床药理学比对试验研究结果可以预测其临床终点的相似性时,则可用于评判临床相似性”。FDA颁布的《证明与参照药具有生物相似性的质量考虑要点》也指出: 如果有PD标识物则应该开展PD研究;如果PK和PD都等效则可以不开展临床有效性比对研究。
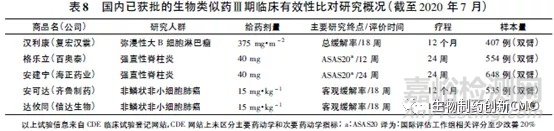
4个单抗生物类似药Ⅲ期试验设计中(见表8),疗程普遍长于主要疗效终点评价时间,汉利康(利妥昔单抗生物类似药)、安可达和达攸同(贝伐珠单抗生物类似药)的疗程甚至达到1年或者更长。除了伦理委员会的要求,这样设计主要是为了深入全面地进行安全性和免疫原性的比对研究。然而,由于和主要疗效终点评价点不一致,给临床实际操作带来一定困难,最终能进行安全性和免疫原性评价的病例数量有限。
同时,由于在药动学研究和有效性研究中只考虑药动学和有效性的相似性来计算样本量,没有考虑到充分的安全性暴露,样本量的估算也存在一定争议。因此在生物类似药临床研究中可做进一步的考虑和探讨:如将安全性和免疫原性的评价时间点和主要疗效终点的评价时间点保持一致或者药品上市之后再评价安全性和免疫原性。如此,一方面可以对Ⅲ期试验中的试验组样本量做出规定,另外一方面也可以为上市后药物警戒提出明确和详细要求。
5 、适应证外推的问题
外推法是指生物类似药可以被用于参照药已被批准但类似药尚未在关键的生物相似性临床试验中被研究的适应证,其对于生物类似药或候选生物类似药的开发至关重要。虽然适应证的外推法减少了生产商开展额外临床试验的需要,但在某些情况下仍然需要进一步的探讨(比如研究对于不同的适应证药物安全性的差异),同时类似药的适应证外推也受限于参照药是否在当地获批。对于生物类似药适应证的外推还应该考虑到每一种适应证不同的药物作用机制,具体来说,就是相关功能的靶/受体、受体结合、剂量-反应关系、结构和靶/受体相互作用以及靶/受体的位置和表达。总而言之,外推法的合理性取决于临床经验、已发表的数据和各种适应证作用机制的同质性。
5.1 欧盟生物类似药适应证外推相关法规和案例
欧盟生物类似药指南指出如果在一个适应证中证明了生物相似性,在适当的科学论证下允许生物类似药外推到参比产品(参照药)的其他适应证。欧盟生物类似药指南进一步指出参比产品(参照药)可能有多个治疗适应证。当在一个适应证中证明了生物相似性时,如有科学证据,可将生物类似药的临床数据外推到参比产品的其他适应证中。如果在某一适应证中确认的安全性和有效性是否与另一个适应证相关存在不确定性,则需要额外补充数据。2017年在EMA批准上市的2个利妥昔单抗(rituximab)生物类似药(Rixathon和Truxima)是适应证外推的典型案例(详见表9)。

5.2 中国生物类似药适应证外推相关法规和案例
中国《生物类似药研发与评价技术指导原则(试行)》指出对于临床比对试验证实相似的,可以考虑外推至参照药的其他适应证。对外推的适应证,应当是临床相关的病理机制和/或有关受体相同,且作用机理以及靶点相同的; 临床比对试验中,选择了合适的适应证,并对外推适应证的安全性和免疫原性进行了充分的评估。
适应证外推需根据产品特点个案化考虑。对合并用药人群、不同合并疾病人群及存在不同推荐剂量等情形进行适应证外推时应慎重。2019年在中国批准上市的4个生物类似药(见表10)也有适应证外推的案例。

6、 结语
生物医药是“十四五”期间我国战略性新兴产业的重点方向,对于我国抢占新一轮科技革命和产业革命制高点,建设“健康中国”具有重要意义。我国生物类似药的上市对于提高生物医药的可及性发挥了重要作用,但也应该看到,以单克隆抗体为代表的生物类似药在部分靶点上已出现拥挤现象。同质化产品在上市前临床试验中会分散受试者病例,迟滞试验进度,而上市后的过度竞争也会造成不良影响。为进一步支持我国生物类似药创新持续发展,笔者提出如下建议,供大家讨论和参考:
①对于生物类似药注册申请,应要求具备一定生产规模。结合产品潜在临床需求、市场容量,研究制定生产规模门槛。
②针对不同品种,特别是临床重大需求品种,在现有指南基础上,建立更具针对性、操作性的研发指南。
③落实临床试验减免要求,加大对产品药学研究资料厚度、可比性研究广度要求,在高质量药学、可比性研究基础上,经审慎评估,可减免Ⅲ期临床试验。
④加强上市后监测要求。

来源:Chinese Journal of New Drugs 2


