您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-11-02 11:42
新修订《药品管理法》(以下简称新《药品管理法》) 和新修订《药品注册管理办法》(以下简称新《办法》)发布后,重新定义了药品加快上市注册程序,强调了鼓励药品创新,以临床价值为导向,对具有明显临床优势或临床价值的药品设立药品加快上市注册程序,包括突破性治疗药物、附条件批准、优先审评审批及特别审批。
1.新法规框架下药品加快上市注册程序相关规定
1.1 相关法规
新《药品管理法》第十六条第一款规定:“国家支持以临床价值为导向、对人的疾病具有明确或者特殊疗效的药物创新,鼓励具有新的治疗机理、治疗严重危及生命的疾病或者罕见病、对人体具有多靶向系统性调节干预功能等的新药研制,推动药品技术进步。”第十六条第三款规定:“国家采取有效措施,鼓励儿童用药品的研制和创新,支持开发符合儿童生理特征的儿童用药品新品种、剂型和规格,对儿童用药品予以优先审评审批。”第二十六条规定:“对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准,并在药品注册证书中载明相关事项。”
新《办法》为鼓励创新和满足临床急需,第十三条规定:“国家药品监督管理局建立药品加快上市注册制度,支持以临床价值为导向的药物创新。对符合条件的药品注册申请,申请人可以申请适用突破性治疗药物、附条件批准、优先审评审批及特别审批程序。在药品研制和注册过程中,药品监督管理部门及其专业技术机构给予必要的技术指导、沟通交流、优先配置资源、缩短审评时限等政策和技术支持。”并专门设立第四章详细规定了“药品加快上市注册程序”4个通道的适用范围。
1.2 工作程序
为配合新《办法》实施,国家药品监督管理局组织制定并发布了相应的实施细则,包括《突破性治疗药物审评工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》,详细规定了各类药品加快上市注册程序的适用范围、认定条例、工作程序和工作要求。
2.原法规框架下药品加快上市注册程序相关规定
2.1 相关法规
《国务院关于改革药品医疗器械审评审批制度的意见》 第(八)条规定加快创新药审评审批。《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告》(2015年第230号)第七条规定加快临床急需等药品的审批,对符合特定条件的实行单独排队,加快审评审批。自2015 年12月1日起,申请人可向国家药品审评部门(以下简称药审中心)提出加快审评的申请。
2.2 工作程序
2016年2月,原国家食品药品监督管理总局发布了《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管〔2016〕19号,以下简称19号公告)规定了优先审评审批的范围、程序和工作要求。2017年12月,在基本解决药品审评审批积压后,原国家食品药品监督管理总局发布了《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号, 以下简称126 号公告),更新了优先审评审批的范围、程序和工作要求(原19号公告同时废止)。
3.新法规框架下药品加快上市注册程序的变化
对比原工作程序,新《药品管理法》和新《办法》药品加快上市注册程序更为科学,不断与国际先进经验接轨,鼓励药品创新,纳入加快上市注册程序的药品范围更为广泛。在原优先审评审批程序的基础上,增加了突破性治疗药物程序、附条件批准程序和特别审批程序。新《药品管理法》和新《办法》为“附条件批准”上市提供了制度依据,有利于临床急需药品的加快上市,有利于建立“附条件批准”的统一标准和评价尺度。同时,在全球抗击新冠肺炎疫情的大背景下,特别审批程序的实施可以使药品监管部门更好地依法对疫情防治所需的药品实行特别审批,加快相关药品的上市进程。对比126号公告的要求,新法规框架下纳入药品加快上市注册程序的适用范围、工作程序和审评时限都有了较大的改变,具体对比如下。
3.1 适用范围变化
新法规框架下药品加快上市注册程序范围更广泛,覆盖了临床试验申请和上市许可申请的全过程,可以在研发申报不同阶段申请多种加快程序。对于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在临床试验期间申请突破性治疗药物程序,申报上市许可生产时申请优先审评审批程序;对于符合规定情形的药品,申请人可以在药物临床试验期间申请附条件批准程序,在药品上市许可申请时申请适用优先审评审批程序;对于规定的具有明显临床价值的药品,申请人可以在药品上市许可申请时申请适用优先审评审批程序;对于突发卫生公共事件应急所需防治药品,可在申报临床和申报上市全过程中申请特别审批程序(图1)。
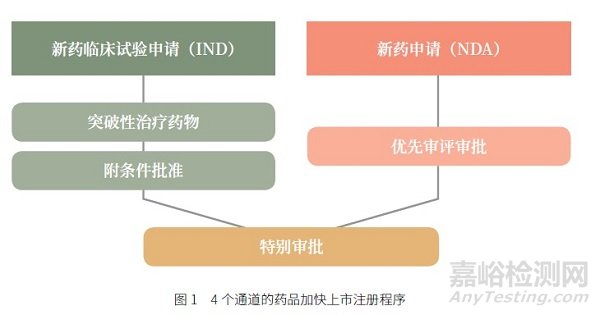
126号公告优先审评审批的范围第(二)条规定,对艾滋病、肺结核等疾病具有明显临床优势的药品注册申请实行优先审评审批。而新《办法》不再具体强调防治何种疾病,重点在于临床急需和临床优势。
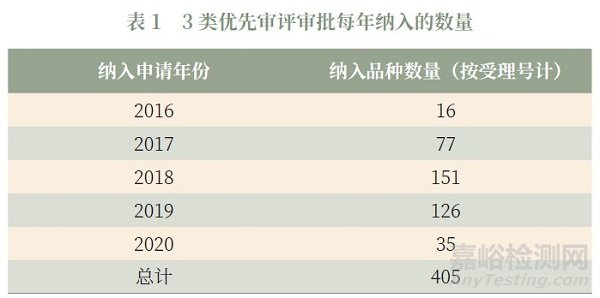
126 号公告中对以下3种情形的药品注册申请实施优先审评审批:①专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请;②申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请,在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请;③列入《关于开展药物临床试验数据自查核查工作的公告》(国家食品药品监督管理总局公告2015 年第117号)的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请。这3类申请数量庞大,约占全部优先审评审批数量的39%,占用了大量审评审批资源。但由于这3类申请大部分都是仿制药,并未体现出临床价值和市场短缺的优势,导致了优先审评审批的效率较低(这3类优先审评审批每年纳入的数量见表1)。新法规框架下药品加快上市注册程序将这3种类型从优先审评审批的范围中删除,去除了大量临床价值不足的药品,大大提高审评审批效率。
3.2 工作程序变化
新法规框架下药品加快上市注册程序明确了可在药品注册申请的同时提出药品加快上市注册申请,并明确了审核时限。对于突破性治疗药物,药审中心应在接到申请后45日内审核并将审核结果反馈申请人;对于优先审评审批程序,药审中心应在接到申请后5日内审核并将审核结果反馈申请人。
新法规框架下药品加快上市注册程序增加了终止程序,对纳入优先审评审批程序的品种,如不再符合纳入条件时,药审中心应当及时提出终止该品种的优先审评审批程序,并告知申请人。同时,药审中心公开优先审评审批程序的纳入品种清单,更新品种状态信息(包括纳入信息和终止信息),及时收录新纳入程序的品种,对终止程序的品种进行标识。
此外,新法规框架下药品加快上市注册程序规定,对于纳入优先审评审批的品种,审评审批过程中可通过“申请人之窗”补充提交技术资料,能有效减少发补次数,提高审评审批效率。
3.3 审评时限变化
126号公告中仅规定了新药生产注册申请和仿制药注册申请自纳入优先审评审批之日起10日内启动技术审评等,并未明确规定纳入优先审评的总体审评时限。新《办法》第九十六条明确规定了优先审评审批程序的审评时限为一百三十日,临床急需的境外已上市境内未上市的罕见病药品优先审评审批程序的审评时限为七十日,提高了审评审批用时的可预见性。
4.过渡期执行方式
针对新旧法律框架下,药品加快上市注册程序不同,为了解决过渡期内法规衔接问题,《国家药监局关于实施〈药品注册管理办法〉有关事宜的公告》(2020年第46号)第六条规定:“(一)新《办法》发布前受理的药品注册申请,按照《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)规定的范围和程序执行。(二)新《办法》发布至实施前受理的药品注册申请,按照新《办法》规定的范围和《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)规定的程序执行。(三)新《办法》实施后受理的药品注册申请,按照新《办法》规定的范围和程序执行。”
5.下一步工作变化
5.1 申请类型发生重大变化
新《办法》发布后受理的药品注册申请,按照新《办法》规定的范围提交药品加快上市注册申请,药品加快上市注册程序的类型不仅有优先审评审批,同时增加了突破性治疗药物、附条件批准及特别审批等类型。新法规框架下的申请将更加鼓励创新,侧重药物的临床优势,以及是否为临床急需用药。因此,新申请品种重点集中在创新药上,仿制药的申请数量会悬崖式下降。
5.2 沟通交流的数量将不断提升
新法规框架下药品加快上市注册程序更加重视沟通交流。对于突破性治疗药物程序,申请人可在临床试验关键阶段申请沟通交流;对于附条件批准程序,申请人就附条件批准上市的条件和上市后继续完成的研究工作申请沟通交流;对于优先审评审批程序,申请人应在提交药品上市许可申请前申请沟通交流,对于初步评估认为符合优先审评审批纳入条件的,应当在会议纪要中予以明确;对于特别审批程序,可通过沟通交流方式进行早期介入。因此,新《办法》执行后,沟通交流的数量将会不断提升。
5.3 审评时限大大缩短
新法规框架下药品加快上市注册程序中加大了前期的沟通交流,申请人可在申报上市申请的同时提交附条件批准和优先审评审批申请,明确了审核时限以及纳入后的审评时限等,同时在审评过程中增加了通过“申请人之窗”补充提交技术资料的方式,多种举措将进一步缩短审评时限,加快具有临床优势和临床急需的药品上市。

来源:中国食品药品监管杂志


