您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-13 14:22
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
泽璟制药肝癌1类新药拟纳入优先审评。泽璟制药1类新药甲苯磺酸多纳非尼片上市申请获CDE纳入拟优先审评公示名单,本次申请的拟定适应症为——用于治疗晚期(无法手术的或转移性)肝细胞癌。在一项Ⅱ/Ⅲ期临床ZGDH3中,与对照药物索拉非尼相比,甲苯磺酸多纳非尼片一线治疗晚期肝细胞癌显著提高了患者的中位总生存期(mOS),达到统计学意义的显著延长。
国内药讯
1.豪森「沙格列汀片」即将获批。豪森4类仿制药沙格列汀片上市申请已变更为"在审批"状态,预计本月获批上市,成为继奥赛康、正大天晴后该品种第3家获批的仿制药。沙格列汀是一种高效的二肽基肽酶-4(DPP-4)抑制剂,用于治疗成人2型糖尿病。原研产品(Onglyza)由百时美施贵宝研发,后被阿斯利康收购,于2011年5月获批进入中国市场,商品名:安立泽。2019年,阿斯利康沙格列汀片全球销售额为5.27亿美元。
2.丽珠注射用丹曲林钠即将获批上市。丽珠制药厂3类仿制药注射用丹曲林钠进入行政审批阶段,即将获批上市。丹曲林钠是一种突触后肌肉松弛剂,可减轻骨骼肌的收缩,为罕见病恶性高热的有效治疗药物,在美国、欧盟、日本等多个国家和地区均有上市,多为胶囊和注射剂。目前国内仅有2家企业持有丹曲林钠胶囊生产批文,暂无注射用丹曲林钠获批上市。
3.康方生物PD-1鼻咽癌注册临床达主要终点。康方生物与中国生物制药联合开发的PD-1派安普利(安尼可,AK105),用于三线治疗转移性鼻咽癌(NPC)的注册性临床达到由独立影像评估的客观缓解率(ORR)主要终点。AK105在既往经过多线治疗后的NPC患者中,展示了良好的临床疗效和安全性。康方生物拟于近期与NMPA进行新药上市申请前沟通。今年5月,派安普利用于治疗至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤的NDA已获NMPA受理。
4.科济生物首创 CAR-T 疗法启动临床。科济靶向CLDN-18.2的自体CAR-T细胞注射液CT041登记启动一项Ib/II期临床,针对至少二线治疗失败的晚期胃/食管-胃结合部腺癌,和至少一线治疗失败的晚期胰腺癌。CLDN18.2 属于紧密连接蛋白家族中的一种亚型,在胃癌、胰腺癌等多种实体瘤中高表达,有望成为实体肿瘤免疫治疗的有效靶标。全球范围内目前尚无同靶点疗法获批。10月5日,FDA已授予T041孤儿药资格认定。
5.歌礼制药FXR激动剂ASC42在美获批临床。歌礼制药旗下甘莱制药开发的拟用于治疗非酒精性脂肪性肝炎(NASH) 的候选药物ASC42获FDA批准开展临床试验。ASC42是一款有望成为同类最佳的新型高效选择性非甾类法尼醇X受体(FXR)激动剂,由专有技术开发成口服片剂,具有室温下稳定的特点。在两个NASH动物模型中,ASC42表现出了对肝脏脂肪变性、炎症和纤维化的显著改善。
国际药讯
1.BMS口服S1P受体调节剂Ⅲ期临床结果积极。百时美施贵宝(BMS)开发的口服S1P受体调节剂Zeposia(ozanimod),在治疗中重度溃疡性结肠炎(UC)的关键性Ⅲ期临床True North中达两个主要终点。与安慰剂相比,Zeposia在诱导治疗期第10周(18.4%vs6.0%;p<0.0001)和维持治疗期第52周(37.0%vs18.5%;p<0.0001)时显著提高获得临床缓解的患者比例。此外,Zeposia治疗组与安慰剂组相比,更多患者在第10周(47.8%vs25.9%,p<0.0001)和第52周(60.0%vs41.0%,p<0.0001)产生临床应答。
2.百时美施贵宝PD-1达到Ⅲ期临床终点。百时美施贵宝PD-1抑制剂Opdivo(nivolumab)与化疗联用,在可切除的非小细胞肺癌(NSCLC)患者中进行的Ⅲ期临床CheckMate-816中达到了病理学完全缓解(pCR)的主要终点。与单独化疗组相比,在手术前接受Opdivo加化疗治疗的患者中,显著有更多患者在切除组织中显示出没有癌细胞存在的证据。CheckMate-816是首个证明免疫检查点抑制剂联合化疗,作为新辅助治疗,为非转移性NSCLC患者提供临床获益的Ⅲ期临床试验。
3.创新抗体偶联药物获FDA突破性疗法认定。FDA授予ImmunoGen公司抗体偶联药物IMGN632突破性疗法认定,用于复发性或难治性母细胞样浆样树突状细胞瘤(BPDCN)的治疗。IMGN632是一款靶向CD123的抗体偶联药物,采用了ImmunoGen新型的吲哚-苯并二氮杂(IGN)载荷(payloads)。根据设计,IGN对急性髓系白血病(AML)的原始细胞有很高的效力,且对正常骨髓祖细胞的毒性较低(相对其他靶向DNA的载荷而言)。目前,它正在多项试验中进行评估。
4.Sobi孤儿药avatrombopag用于血小板减少症临床失败。瑞士孤儿药制药商Swedish Orphan Biovitrum(Sobi)公布了口服血小板生成素受体激动剂Doptelet®(avatrombopag)用于实体瘤患者化疗诱导的血小板减少症治疗的Ⅲ期临床主要结果。尽管与安慰剂相比,该新药增加了血小板计数,但未达到避免血小板输注、化疗剂量减少15%或更多、化疗剂量延迟4天或更久的复合主要终点。在意向治疗人群中,两组的主要终点应答者比例分别为69.5%和72.5%(p=0.72);在预方案治疗人群中,两组的这一数值分别为85.0%和84.4%(p=0.96)。
5.强生新冠疫苗2亿剂供应协议获EC批准。强生宣布,欧盟委员会(EC)已批准一项预先购买协议,由强生旗下杨森制药在监管机构批准或授权后向欧盟成员国提供2亿剂新冠候选疫苗。欧盟成员国还可以选择获得最高2亿剂额外疫苗。为履行该公司对应对新冠疫情作出的更大范围承诺,强生还宣布将分配多达5亿剂新冠疫苗用于国际抗疫,确保低收入国可获得疫苗。这批疫苗将在监管机构批准或授权后于明年年中开始交付。
6.武田与Arrowhead公司达成一项研发合作。武田与Arrowhead公司将共同开发 “first-in-class”RNAi疗法ARO-ATT,用于治疗α-1抗胰蛋白酶相关肝病(AATLD)。ARO-AAT旨在减少突变α-1抗胰蛋白酶蛋白(AAT)的产生,它是AATLD疾病进展的根源。根据协议,武田和Arrowhead将在美国共同开发、商业化ARO-AAT;在美国以外,武田将主导全球商业化战略,并获得ARO-AAT商业化的独家许可。Arrowhead将获得3亿美元的前期付款,高达7.4亿美元的潜在开发、监管和商业化里程碑付款。
医药热点
1.接种新冠肺炎疫苗不纳入医保支付范围。国家医保局公布了《对十三届全国人大三次会议第9354号建议的答复》,针对有全国人大代表提出“将接种新冠肺炎疫苗纳入医保全额报销”的建议,国家医保局答复称,国家有关规定明确“预防性疫苗不纳入医保支付范围”。另外,此次疫苗接种人数众多,所需费用总额高,明显超出医保基金承受能力。据统计,截至7月19日,全国新冠肺炎确诊和疑似患者发生医保结算13.55万人次,涉及医疗费用18.47亿元,医保支付12.32亿元,支付比例达到67%。
2.青岛新增核酸检测结果阳性9人。据青岛市卫健委网站消息,2020年10月11日,青岛市发现3例新冠肺炎无症状感染者后,立即组织开展大规模的流调排查和分类检测。共排查到密切接触者和市胸科医院所有在院患者及陪护人员377人,其中新增核酸检测结果阳性9人,包括8名市胸科医院在院患者及陪护人员、1名患者家属,经专家组判定,其中4例为确诊病例、5例为无症状感染者。截至10月11日23时,青岛市共发现6例确诊病例;6例无症状感染者。
3.第三款国产阿达木单抗苏立信®定价出炉。10月10日,据新浪医药最新求证,信达生物的第三款国产阿达木单抗(苏立信®)价格公布——市场售价为1150元/瓶。同时,苏立信®的赠药政策也首次公开:信达生物将拿出12000支苏立信®用于该援助项目,低收入患者可以享受买4赠2的赠药援助;低保患者可以免费使用6支苏立信®。苏立信®在今年9月正式上市,获批适应症为治疗类风湿关节炎、强直性脊柱炎和银屑病。
股市资讯
【大博医疗】公司获得髋关节假体髋臼内衬《医疗器械注册证》,该产品与同一系统组件配合,适用于髋关节置换。
【凯利泰】公司于近日获得哥伦比亚主管当局同意核准金属交锁髓内钉的注册,该产品产品主要应用于股骨、胫骨、肱骨和股骨粗隆间骨折的髓腔内固定。
【泽璟制药-U】公司1类抗肿瘤新药甲苯磺酸多纳非尼片近日被国家药品监督管理局药品审评中心纳入拟优先审评审批品种公示名单。
审评动向
1. CDE最新受理情况(10月12日)
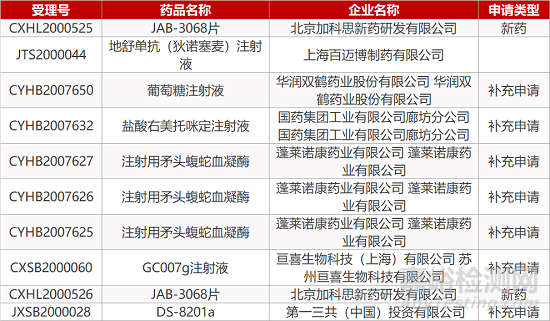
暂无
- The End -

来源:药研发


