您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-08 17:28
目前我国药品的供求关系已发生根本改变,药品的可及性已非主要矛盾。医药产业“多、小、散、低”的格局没有发生根本性改变,迫切要求整合资料,提高医药行业的水平。随着国际合作的加强以及我国企业进军国际市场,均要求我们在资料上与国际统一CTD格式。符合药品研发的规律,能更有效地展现研发过程,利于评价。而申报资料的本质是数据的提交,申报资料的结构日趋复杂化和多样化,质量参差不齐,缺乏清晰度,导致审评困难,完整审评时数据的数量和种类也需要全面掌握。
一 CTD概念
CTD文件是国际公认的文件编写格式,制作一个向药品注册机构递交的结构完善的注册申请文件,共有5个模块,模块1是地区管理资料,模块2、3、4和5在各个地区是统一的。模块1是指地区性行政信息和法规信息,包括各地区的特殊文件,例如申请表或在各地区被建议使用的标签,其内容和格式可以由每个地区的相关注册机构来指定。模块2是指CTD文件概述和综述,由7个部分组成,如图1所示,是对药物质量,非临床和临床试验方面内容的高度总结概括,必须由合格的和有经验的专家来担任文件编写工作。其中“2.1”为CTD总目录,“2.2”为申请药品的一般介绍,主要介绍药品的药理作用及临床适应证,“2.3~2.7”为具有资历的专家的相关综述和概要,包括:质量概要、临床前综述、临床综述、临床前研究列表总结和表格概要、临床研究概述。模块3是指质量部分(药学包括原料药和制剂),提供药物在化学、制剂和生物学方面的内容。模块4是指非临床前研究报告,提供原料药和制剂在毒理学、药理学及药动学试验方面的内容。模块5是指临床研究报告,提供制剂在各项临床试验方面的内容。
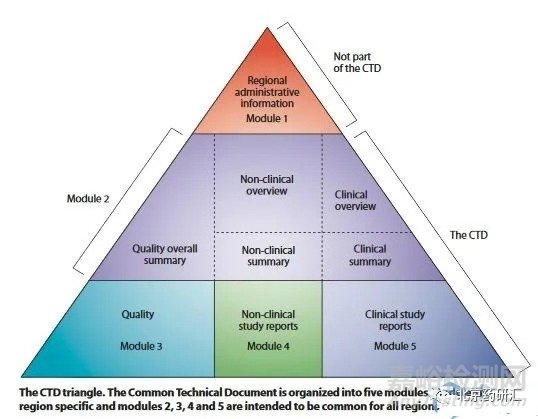
CTD由5个模块构成,自上而下呈倒金字塔形,所含内容自上而下逐步细分。其中模块1具有地区特异性;模块2、3、4、5为通用文件,适用于所有应用CTD的各个地区。
二 CTD资料常见的问题
CTD格式的申报资料体现了过程控制和终点控制相结合的、全面系统的药品质量控制理念,更加符合药学研发的一般规律,其实施将有助于我国药品研发的水平向国际先进标准看齐,也有利于推动国产仿制药在欧美的出口注册。CTD格式申报品种审评中发现的主要问题,归纳如下:
1、未真正按照过程控制和终点控制相结合的、全面系统的药品质量控制理念,进行系统而深入的研发,仅简单地将原有的申报资料按照CTD的格式重新组合。
2、信息汇总表过于简单。应将药学研究中的主要研究项目进行综述,并将重要的研究过程、内容与数据列出,不能简单地注明参见申报资料XX章节。否则不利于审评人员在审评时通过信息汇总表对申报品种的工艺可行性与质量控制体系的可靠性及全面性有一个整体的了解与判断。同时因为信息汇总表是审评报告的重要组成部分,如果其信息不够全面、重要信息缺失,还会严重影响审评的效率。
3、在工艺研究中未结合大生产的设备、操作流程和拟定规模对处方、生产工艺进行系统的筛选和优化;也未对关键步骤及其工艺参数控制范围进行全面的研究与验证,将关键工艺步骤及关键工艺参数与普通的工艺及参数混为一谈,有些品种更是直接将S.2.2 (或P.3.2) “生产工艺和过程控制”中的内容全部拷贝粘贴在S.2.4(或P.3.3)“关键步骤和中间体的控制”这一章节中;未按照相关要求提供无菌、除菌工艺的验证资料。现有资料无法证明申报的品种已具备大生产的可行性,并能在实际生产线上持续生产出质量合格的药品。
4、在“S.3.2 杂质”部分未结合在研产品的生产工艺、结构特点、降解途径以及现行版国内外药典等文献对其杂质谱进行全面分析,并对研究中涉及的各特定已知杂质的结构进行研究确证,同时根据其生产工艺、化学结构与文献资料等对杂质的来源进行合理的分析,为后续的杂质控制研究奠定基础。
5、在S.4.2(或P.5.2) 分析方法一节中未按要求列明各色谱方法的色谱条件和溶出度检查的溶出条件、定量方法等;在质量研究中未根据杂质谱分析的结果筛选合适的杂质分析方法、并采用相应的杂质对照品对优选后拟采用的分析方法进行全面的方法学验证,而仅采用主成分对杂质分析方法进行检测限等的验证,所得结果无法证明该方法确实能够检出各特定杂质;未根据杂质研究技术指导原则的要求和质量对比研究及稳定性考察的结果,在质量标准中制订各特定杂质、其他任一单个杂质和总杂质的合理限度。
6、未准确理解设置放行标准与货架期标准(即通常所说的注册标准)的重要意义,未根据标准中各项目在生产及放置过程中的变化趋势分别设定合理的限度,从而不能充分发挥放行标准在保证有效期内产品质量始终符合货架期标准中的作用。
7、申报生产的资料中未详细提供临床研究用样品的批生产记录和质量研究资料,也未比较并说明其处方工艺是否与申报的大生产的处方工艺一致。如果临床样品的批量、主要生产设备的型号、关键技术参数等与拟定的生产线有不同,应详细分析这些差异是否会影响产品的质量,并提供相应的研究验证资料。
三 小结
CTD申报资料撰写的关键点是逻辑性、全面性及可追溯性,呈现研究思路、详细过程、结果和分析总结,重点是最终确定的(处方)工艺、质量标准的相关内容,摸索实现最终目标的过程简单总结。
通过原料药的生产工艺,或制剂的处方、生产工艺开发,对关键工艺环节进行研究,建立关键工艺参数控制,对药品关键质量特性和稳定性进行研究与确认。在商业化大生产的条件下,保证工艺能够稳定、持续生产出质量符合要求的药品,并建立系统、有效的药品生产质量控制体系。

来源:北京药研汇


