您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-19 09:13
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
上海医药引进贝伐珠、曲妥珠、阿达木、PD-1等6款生物药。上海医药全资子公司SPH PROJECT BIOCAD (SPH PB)与BIOCAD Holding Hong Kong (BIOCAD HK)将合资新设合资公司,注册资本金4亿美元。其中,SPH PB以现金出资2.004亿美元,占合资公司50.1%股权;BIOCAD HK以现金2994万美元及6个产品在大中华区的永久、独家的研发、生产、销售及其他商业化权利(预估值为1.6966亿美),占合资公司49.9%股权。6个合作产品包括3个生物类似药和3个创新生物药。分别为贝伐珠单抗生物类似药、曲妥珠单抗生物类似药、阿达木单抗生物类似药、IL-17A抗体、抗PD-1单抗和TNF受体(GITR)激动性抗体。
国内药讯
1.齐鲁华法林钠片首家通过一致性评价。齐鲁制药仿制药华法林钠片获国家药监局核发的一致性评价批件。华法林钠片属于双香豆素类中效抗凝剂,适用于需长期持续抗凝的患者,能防止血栓的形成及发展。该药原研药最早于1954年在美国获批上市。据Insight数据显示,该品种获批上市的国内生产企业共5家,齐鲁制药是该品种国内首家通过一致性评价的药企。
2.复星医药tenapanor片临床申请获受理。复星医药合作品种tenapanor片临床申请获国家药监局受理。tenapanor是一款全新机制的NHE3小分子抑制剂,由Ardelyx公司开发,近日刚获FDA批准用于治疗便秘性肠易激综合征(IBS-C)成年患者。复星医药于2017年12月获得该药物在中国的开发和商业化权益。两项Ⅲ期试验结果显示,与安慰剂组相比,该药达到试验的主要终点。在第一项临床试验中治疗组达缓解的患者比例为37%,对照组为24%,在第二项临床试验中,治疗组的数值为27%,对照组为19%。
3.药欣生物CDK4/6抑制剂在美获批临床。药欣生物宣布其自主研发的505b2创新抗乳腺癌制剂HLK-1001胶囊获FDA临床试验批准,将在美国开展临床试验。HLK-1001胶囊是一种CDK4/6抑制剂,拟用于治疗ER阳性/HER2阴性绝经后晚期乳腺癌。药欣生物利用其独特的难溶药固体制剂平台,消除进食对药物吸收影响,提高患者依从性和有效性。目前,该产品的专有技术已获得中美两国专利授权,并在多国进行专利申请。
4.联邦制药德谷胰岛素注射液获批临床。联邦制药全资附属公司珠海联邦制药的糖尿病用药德谷胰岛素注射液(规格:3ml:300单位(笔芯);3ml:300单位(预填充))获国家药监局临床批件,受理号CXSL1900062。德谷胰岛素是目前基础胰岛素中作用时间最长的新型胰岛素类似物,其药物作用时间可维持42小时,且具有控糖平稳、安全性高等特点。德谷胰岛素原研产品2018年已在中国获批上市,目前尚无国产产品获批上市。德谷胰岛素属于国家医保目录(2019年版)药品。
5.北海康成奈拉替尼获孤儿药资格。北海康成合作品种奈拉替尼(Nerlynx)获FDA授予治疗乳腺癌脑转移患者的孤儿药资格。Nerlynx是由Puma Biotechnology开发的一种强效的不可逆的酪氨酸激酶抑制剂,通过阻止泛HER家族(HER1,HER2和HER4)及下游信号通路转导,抑制肿瘤生长和转移。北海康成通过授权获得其在大中华地区的开发和商业化权益。目前,该产品的中国上市申请已获国家药监局受理。该药2017年7月已获FDA批准用于早期HER2阳性乳腺癌在完成曲妥珠单抗辅助治疗后的强化辅助治疗。
国际药讯
1.FDA推出“ORBIS计划” 加快创新肿瘤药全球上市。9月17日,FDA在官网正式宣布一项由肿瘤卓越中心推出的“Project Orbis”计划。Orbis 计划为FDA及其国际合作的监管机构提供了一个针对肿瘤产品的共同提交和审批协作框架。Orbis 计划的首批协作药监机构包括FDA、澳大利亚TGA、加拿大卫生部。在Orbis 计划的工作框架下,FDA、TGA、加拿大卫生部只负责肿瘤产品的申请提交和审批,不对产品价格或进出口做任何决定。另外,获批产品在美国、澳大利亚、加拿大的药品标签允许有差异。
2.Keytruda组合疗法获批治疗特定子宫内膜癌。FDA批准默沙东的重磅PD-1抑制剂Keytruda,与卫材的口服酪氨酸激酶抑制剂Lenvima联用,治疗特定晚期子宫内膜癌患者。这一加速批准是在FDA实时肿瘤学审评项目下完成。而且依据FDA肿瘤卓越中心的另一试点项目Orbis,美国,澳大利亚和加拿大三个国家的药监机构同时审评并批准了这一申请。一项Ⅱ期临床KEYNOTE-146/Study 111结果显示,在94例非MSI-H或dMMR晚期子宫内膜癌患者中,该组合达38.3%的客观缓解率,完全缓解率为10.6%,部分缓解率为27.7%。在中位随访时间为18.7个月时,患者的中位缓解持续时间尚未达到。产生缓解的患者中69%生存期超过6个月。
3.强生前列腺癌新药Erleada新适应症获FDA批准。强生旗下杨森前列腺癌药物Erleada(安森珂®,apalutamide,阿帕他胺)的新适应症获FDA批准,用于治疗转移性去势敏感性前列腺癌患者。一项III期临床TITAN结果显示,与安慰剂+雄激素剥夺治疗(ADT)相比,Erleada+ADT治疗组OS表现出改善、死亡风险降低33%;其rPFS也表现出改善、放射学进展或死亡风险降低52%。中位随访22.7个月,Erleada+ADT治疗组的2年OS率为84%,安慰剂+ADT治疗组为78%。接受Erleada治疗的患者中最常见的不良反应(≥10%)包括:疲劳、关节痛等。
4.诺华重磅IL-17A抑制剂达Ⅲ期临床终点。诺华公司开发的全人源抗IL-17A单抗Cosentyx(secukinumab,司库奇尤单抗)治疗非放射性轴性脊柱关节炎(nr-axSpA)的Ⅲ期试验PREVENT达主要临床终点和所有次要终点。该研究评估Cosentyx治疗nr-axSpA患者的疗效和安全性。结果显示,与安慰剂相比,接受Cosentyx治疗的患者的疾病活性具统计学意义的显著降低;在16周时,达到脊柱关节炎国际协会评定40(ASAS40)标准的患者比例显著高于对照组。Cosentyx同时达到试验的所有次要终点。安全性与之前研究一致。诺华预计今年晚些时候向FDA递交监管申请。Cosentyx此前已获批治疗PsA,AS以及银屑病。
5.默沙东埃博拉疫苗获FDA优先审评资格。默沙东宣布,FDA已受理其埃博拉疫苗V920的上市申请,用于预防埃博拉病毒引起的疾病。FDA同时授予V920优先审评资格,预计明年3月14日前作出回复。V920是由改造过的水疱性口炎病毒和埃博拉病毒表面的重要糖蛋白组成。此次申请是基于V920曾在刚果保护人们免受埃博拉病毒侵袭时所积累的临床数据。据WHO的初步数据,V920可能有效保护个体免受埃博拉病毒感染。在接种V920预防治疗的93000多名高危人群中,只有71人感染病毒(感染的患者大多数在疫苗接种生效前已出现疾病症状)。此外,已有研究表明V920可将预防效果维持长达两年。
6.Edgewise Therapeutics完成B轮融资。生物技术公司Edgewise Therapeutics完成5000万美元B轮融资。此次融资由Novo Holdings A/S和US Venture Partners领投。Edgewise Therapeutic是一家位于美国科罗拉多州博尔德市的生物技术公司,该公司正在开发用于治疗高发病率肌肉骨骼疾病的创新药物。Edgewise Therapeutics拟利用本轮融资资金推进其候选产品进入杜氏肌营养不良症(DMD)和Becker肌营养不良症(BMD)的临床开发阶段,并扩大其产品线。
医药热点
1.新加坡叫停8种胃酸药销售。17日消息,因为药物中被发现含有NDMA(N-亚硝基二甲胺)杂质且NDMA含量超过国际标准,新加坡卫生科学局暂停了八种胃酸类药物的销售和供应。目前国际卫生监管机构已对这些药物发出了警告,FDA和欧洲药管局都表示,他们正在调查用于治疗胃灼热和其他胃肠疾病的药物的NDMA含量。这类药物的有效成分叫做雷尼替丁(ranitidine),包括赛诺菲的Zantac及其仿制药。新加坡官员表示,他们正与供应这些药物的公司和国际监管机构合作,以核实污染的原因。
2.2019年吴阶平医学奖、吴阶平医药创新奖揭晓。9月17日,2019年吴阶平医学奖评审委员会终审会议在北京欧美同学会召开,评委对2019年吴阶平医学奖候选人的推荐材料认真审阅和广泛讨论后,经无记名投票,将2019年度吴阶平医学奖授予中西医结合血液病学专家张亭栋教授,中国工程院院士、呼吸病学与危重症医学专家王辰教授。同时,宣布了2019年度吴阶平医药创新奖获奖名单:董晨、张卫东、王伟、令狐恩强、王升启、陈翔。
3.南京对医疗卫生领域实行信用分类监管。南京市卫健委出台“南京市医疗卫生信用分类监管办法”,对医疗卫生机构、从业人员等进行信用等级评价。医疗卫生信用分类从高到低分为“诚实守信”(A级)、“信用良好”(B级)、“一般失信”(C级)、“较重失信”(D级)、“严重失信”(E级)等五类。对信用较好的信息主体,坚持自律为主、监管为辅的原则,在信用等级有效期内,享受激励措施。对信用较差的信息主体,将加强监管。根据监管办法,信息主体的负面信息一共包含十九方面。
【景峰医药】“盐酸替罗非班氯化钠注射液”补充申请已获正式受理。
审评动向
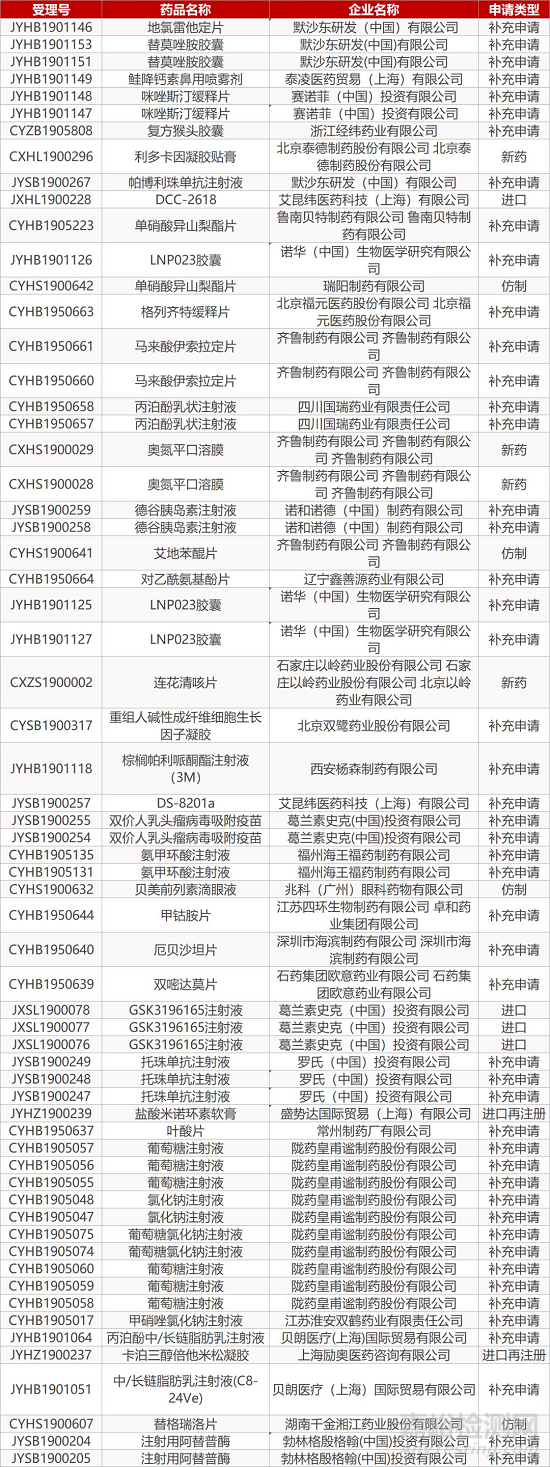
1. CDE最新受理情况(09月18日)
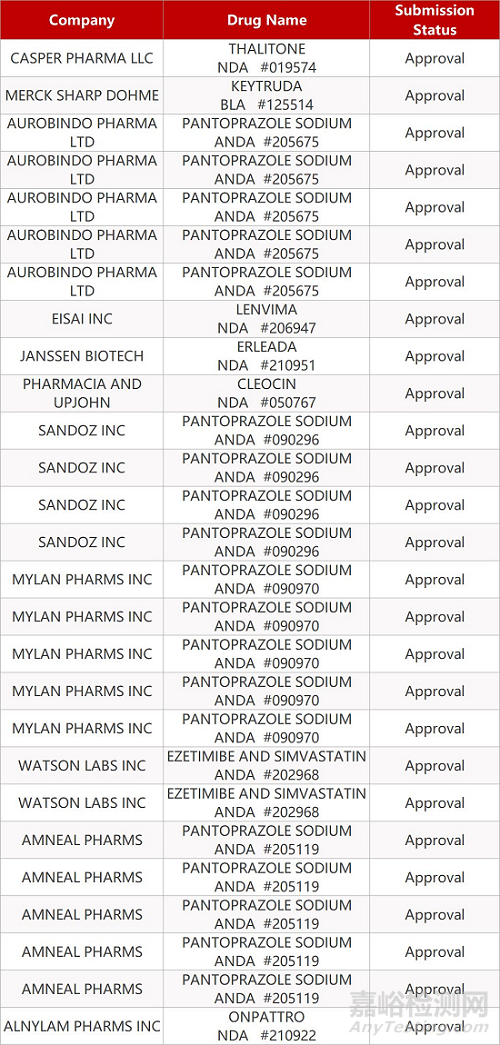
2. FDA最新获批情况(北美09月17日)

来源:药研发


