您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-06-26 17:03
摘要:
目的:评估聚氨酯人工血管的综合物理性能。
方法:参照行业标准YY0500-2004《心血管植入物人工血管》中的方法,测试聚氨酯人工血管的轴向拉伸强度、周向拉伸强度、薄膜加压破裂强度、缝线牵拉强度、反复穿刺后强度、渗透性以及扩张内径。
结果:试验得到样品各测试项目的均值分别为轴向拉伸强度770.81 N、周向拉伸强度6.71 N·mm-1、薄膜加压破裂强度294.78 kPa、缝线牵拉强度34.89 N、反复穿刺后强度2264 mmHg、渗透性为0 mL·min-1、扩张内径2.20%。
结论:加强型聚氨酯材料人工血管有较好的综合物理性能,具有较高的临床应用价值。
心血管疾病是危害人类健康的常见疾病之一,其发病率和死亡率在全球范围内居高不下[1-3]。血管移植和血管重建修复是心血管疾病的主要或辅助治疗手段[4]。移植血管的主要来源为生物血管或人工血管[5]。同种异体生物血管和异种生物血管移植物易形成血栓,且来源紧缺[6]。自体生物血管大多来源于自体静脉血管,不仅来源有限,带来的创伤也比较大[7],并且,在实际临床中,有将近1/3的病人由于各种原因无法进行自体血管的移植[8-9]。所以临床上需要大量的人工血管作为移植替代物。
人工血管的开发和研制距今已有6 0多年的历史,目前用于制造人工血管的原料有涤纶(PET)、膨体聚四氟乙烯(ePTFE)、聚氨酯(PU)和天然桑蚕丝等[10-12]。其中,聚氨酯材料因其优良的生物相容性(包括血液相容性和组织相容性)、耐磨性及耐疲劳等性能受到了广泛的关注和应用[13-15]。但是,针对其物理性能的评价,目前多为单一项目的定性评估,缺少综合多方面物理性能测试的综合性评价。
本文以聚氨酯为主体,使用涤纶编织加强的人工血管为试验对象,参考行业标准YY0500-2004 《心血管植入物人工血管》中的方法,针对其包括拉伸强度、薄膜加压破裂强度、缝线牵拉强度、反复穿刺后残余强度、渗透压以及扩张内径多个物理项目进行了试验,力求从多方面综合评估其物理性能,为其物理性能的深入探究和更好的临床应用提供技术支撑。
1 材料、仪器与方法
1.1 材料
本试验使用的人工血管内外两层为医用聚氨酯,中间加强层为涤纶编织。血管直径为34 mm,长度为20 cm,壁厚为0.5 mm。试验样品数量共5支,由武汉扬森股份有限公司提供。
1.2 仪器
LST-40/JIB2单向激光测径仪(雷斯特);P1021-A-6软管水压综合测试台(深圳亿威仕自动化设备有限公司);数字式胀破强度测试仪YG032E(泉州市美邦仪器有限公司);万能材料试验机H5KS(Tinius Olsen)。
1.3 试验方法
目前,人工血管的物理性能测试,业内参照标准为YY0500-2004《心血管植入物人工血管》,该标准详细规定了测试的项目和方法,本研究立足于该标准,针对聚氨酯人工血管,展开多项物理性能测试。
1.3.1 轴向拉伸强度
轴向拉伸强度是测定管状血管移植物管型状态下的轴向拉伸强度。
试验中将样品的两端分别固定在万能材料试验机的夹具上,夹具间距为50 mm。小心确保样本没有被拉伸、扭曲或被夹具损坏,应尽量保持自然状态。然后以150 mm·min-1的速率匀速拉伸样本,直至样本断裂,记录断裂时的载荷值即为其轴向拉伸强度。
1.3.2 周向拉伸强度
周向拉伸强度是测定管状血管移植物管型状态下圆周方向拉伸强度。
从样品上截取长度为40 mm的供试样本,记为样本的长度(L),单位为mm。将样本放置在万能材料试验机夹具的两个销上,确保样本无拉伸或扭曲,保持自然状态。以150 mm·min-1的速率拉伸样本,直至达到断裂点。记录最大负载(Tmax)。
将每个样品的最大负载(Tmax)除以其原始样品长度来计算周向拉伸强度。公式如下:

1.3.3 薄膜加压破裂强度
薄膜加压破裂强度用于测定管状血管移植物平片型状态下的破裂强度。
试验截取长度为100 mm的样本,再沿纵轴方向切开,抚平,形成厚度均匀的平片。将平片的样品放置在数字式胀破强度测试仪底座的开口上,使样品完全覆盖加压薄膜,固定夹具环。以200 mL·min-1的速率均匀增加薄膜下面的压力,直到样品破裂,记录破裂强度。
1.3.4 缝线牵拉强度
测定将缝线拉出管状血管移植物管壁的力。
沿轴向截取一段长度约为20 mm的样本,使用6-0尼龙缝线(直径0.16 mm)在距伸直样本一端2 mm处插入并穿过一层血管壁,缝合成一个半环。以150 mm·min-1的速率拉伸缝线,记录将缝线从血管假体中拉出,或导致血管假体壁损坏的拉力大小。
1.3.5 反复穿刺后残余强度
沿人工血管的纵轴方向截取一段样品后沿轴向剪开,抚平后使用16 G的穿刺针,在血管表面进行每平方厘米24次穿刺。穿刺后的样品放置在开口为1 cm2的薄膜加压设备上,均匀增压,直到样品破裂,记录此时的压力值,即为反复穿刺后的残余强度。
1.3.6 渗透压
将样品连接到软管水压综合测试台上,然后用生理盐水充盈血管,逐渐增加压力至100 kPa,观察样品的外表面是否出现水珠。
1.3.7 扩张内径
使用圆锥规预先测量血管内径,使用标称壁厚计算血管外径,外径=内径+(标称壁厚×2)。对样品施加一定预压力,使其外径与前述外径相差在±0.1 mm以内,此时认为是测试的压力零点,开始测试。将人工血管与水压发生器相连,保持压力为180 mmHg,使用单项激光测径仪测量血管的外径,计算扩张内径,得到扩张比=(扩张内径-初始内径)/初始内径。
2 结果
对试验样品分别进行上述物理学试验,所得到的试验结果如表 1所示。
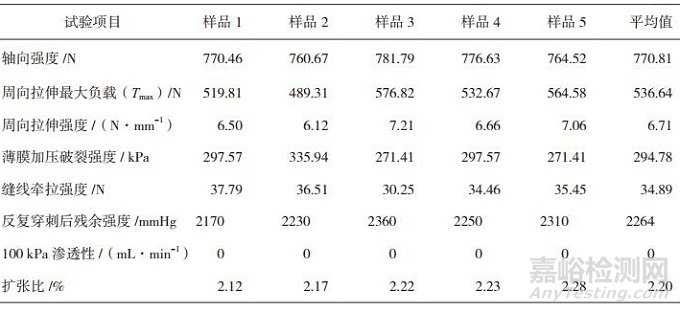
表 1 聚氨酯血管综合物理性能试验结果
3 讨论
体内血管由于肌肉收缩、运动等原因不断地受到轴向应力。因此,理想的人工血管必需具有与人体自然血管相近甚至更好的轴向力学性能。人体股动脉的极限应力为1~2 MPa[16]。由表 1可见,本研究中所用聚氨酯人工血管的轴向拉伸强度均值为770.81 N,等效于7.2 MPa,远高于人体极限值,有较好的抗拉性能。
由于人工血管在脉动血流环境下长期工作,正常的收缩压为12.0~18.7 kPa,舒张压为8.0~12.0 kPa,人工血管的耐压性能越好,使用的可靠性就越大[17]。试验结果表明,样品周向拉伸强度均值为6.71 N·mm-1,薄膜加压破裂强度均值为294.78 kPa,并且,经反复穿刺试验后,得到样品的反复穿刺后强度均值为2264 mmHg,约为302 kPa。可见样品有良好的耐压性,能够满足人体使用要求。
人工血管的缝线牵拉强度关系到缝合操作的难易和吻合口的强度,关系到植入后人工血管连接的牢固性,是一项十分重要的力学性能[17]。该缝线牵拉强度均值为34.89 N,能够满足手术植入操作和人体使用的要求。
在渗透性方面,试验样本均未表现出渗漏的情况,表示血管在远高于人体血管内部压力的条件下,有良好的抗渗漏性,即手术时无需预凝,人工血管可直接用于移植等外科手术,并且有利于防止血管在植入后由于血液的渗出造成血肿等并发症。
对于扩张内径,在模拟人体高压,180 mmHg的加压条件下,血管的内径扩张均值为2.20%,能够较好地匹配人体血管,防止吻合处内膜增生,导致血栓栓塞。
上述试验,从拉伸强度、薄膜加压破裂强度、缝线牵拉强度、反复穿刺后残余强度、渗透性、扩张内径多个方面,对加强型聚氨酯人工血管性能进行试验,结果表明,聚氨酯材料人工血管具有较好的物理性能,有较好的临床使用价值。
与此同时,人工血管作为一种长期体内植入物,其植入体内后,将长时间地面对人体的各个方向的血流冲击摩擦、肌体牵拉,以及与体液和细胞之间的生化作用,其物理和化学性能都将发生改变。在新的血管再生之前,任何力学性能的缺失都有可能导致移植的失败。然而,现行的标准YY0500-2004《心血管植入物人工血管》中并没有对人工血管在持续脉动压力后的长期力学性能进行评估的明确要求,更没有明确的测试方法。目前国家的人工血管注册检验,也并没有硬性要求厂家提供人工血管疲劳测试,以及疲劳测试后相关力学性能的评估材料。由此看来,目前我国现行的标准,尚存在一定的缺失。
在心血管疾病高发的全球环境下,人工血管的研发与应用受到了广泛的关注。如何更加全面、客观地完善检验方法,更加准确地评估人工血管的特性,确保其植入人体后充分发挥作用将是我们继续努力探索的方向。
参考文献
[1] Zhang L, Zhou J Y, Lu Q P, et al. A Novel Small-Diameter Vascular Graft:In Vivo Behavior of Biodegradable Three-Layered Tubular Scaffolds[J]. Biotechnolgy and Bioengineering, 2008, 4(99): 1007-1015.
[2] 黄云. 浅述中成药在心血管疾病中的应用[J]. 健康周刊, 2018, 11(12): 214-215. DOI:10.3969/j.issn.2096-1499.2018.12.207
[3] 王超. 重组人脑利钠肽治疗急性心力衰竭的研究进展[J]. 中国处方药, 2018, 16(1): 23-25. DOI:10.3969/j.issn.1671-945X.2018.01.016
[4] 郭铁芳, 杨大平, 韩雪峰. 血管组织工程研究进展[J]. 哈尔滨医科大学学报, 2002, 36(2): 172-174. DOI:10.3969/j.issn.1000-1905.2002.02.038
[5] Wang X W, Lin P, Yao Q Z, et al. Development of Small Diameter Vascular Graft[J]. World J Surg, 2007, 31(4): 682-689. DOI:10.1007/s00268-006-0731-z
[6] 贾立霞.人造血管水渗透仪的设计及其渗透性表征的实验研究[D].上海: 东华大学, 2001: 2. http://cdmd.cnki.com.cn/Article/CDMD-10255-2004042320.htm
[7] 管清海, 陈强谱, 张长习. 血管移植物在腹部静脉修复重建中的应用[J]. 中国现代普通外科进展, 2011, 14(4): 299-301.
[8] Veith F J, Moss C M, Sprayregen S, et al. Propertive Saphenous Venography in Arterial Reconstructive Surgery of the Lower Extremity[J]. Surgery, 1979, 85(3): 253-256.
[9] Edwards W S, Holdefer W F, Mohtashemi M. The Importance of Proper Caliber of Lumen in Femoral Popliteal Artery Reconstruction[J]. Surg Gynecol Obstet, 1966, 122(1): 37-40.
[10] Murray W J, Lyman D J, Wijelath E S. Vascular Graft Headling. Ⅲ. FTIR Analysis of ePTFE Graft Samples from Implanted Bigrafts[J]. J Biomed Mater Res Part B:Appl Biomater, 2004, 70(2): 223-232.
[11] Cho E H, Yang Y L, Mun C W, et al. Tissue-Engineered Semi-Microporous Segmented Polyetherurethane Vascular Prostheses[J]. J Biomater Sci Polym Edn, 2005, 16(6): 775-790. DOI:10.1163/1568562053992441
[12] Kannan R Y, Salacinski H J, Butler P E, et al. Current Status of Prosthetic Bypass Grafts:A Review[J]. J Biomed Mater Res Part B:Appl Biomater, 2005, 74(1): 570-581.
[13] 程戈, 付慧莉. 聚氨酯人工血管改性促进内皮化研究进展[J]. 数码设计(上), 2017, 6(3): 26-28.
[14] 徐雅硕, 钟银屏, 付强, 等. 聚氨酯人工血管的研究进展[J]. 功能材料, 2012, 43(z1): 6-9.
[15] 赵宏生, 蔡海波, 潘肇琦, 等. 生物载体用聚醚型聚氨酯多孔材料的研究[J]. 南方医科大学学报, 2011, 31(12): 2006-2011.
[16] Sell SA, Mcclure MJ, Barnes CP, et al. Electrospun Polydioxanone Elastin Blends:Potential for Bioresorbable Vascular Grafts[J]. Biomed Mater, 2006, 1(2): 72-80. DOI:10.1088/1748-6041/1/2/004
[17] 潘仕荣, 杨世方, 易武, 等. 小径微孔聚氨酯人工血管的制备条件对微观结构与性能的影响[J]. 中国修复重建外科杂志, 2005, 19(1): 64-69. DOI:10.3321/j.issn:1002-1892.2005.01.018
作者:李崇崇,中国食品药品检定研究院

来源:xml-data


