摘要
目的:为规范生物制品早期研发工作,提高早期研发质量管理水平提供建议,提升生物制品的研发质量与效率。方法:汇总我国现行与生物制品研发质量管理相关的法规,分析法规要求与生物制品研发现状的契合度,根据生物制品早期研发阶段的特点,概括早期研发过程中存在的研发质量管理问题,提出解决问题的对策与建议。结果:现阶段我国已颁布的与生物制品研发质量管理相关的法规主要涉及研发中后期,对于早期阶段的质量管理,缺少明确、细致、可执行的法规文件。生物制品早期研发过程中在组织架构/人员设置、职能划分、管理制度、制度执行与培训、研究资料、物料和供应商管理以及样品管理7个方面存在问题。结论:加强生物制品早期研发过程的研发质量管理应注意以下几点内容:(1)建立权责明确的生物制品研发质量管理部门;(2)建立层次分明的生物制品研发质量管理文件体系;(3)采取“纵横交错、贴合实际”的原则来制定研发质量管理文件;(4)加强质量管理工具的应用;(5)采用项目管理模式开展生物制品早期研发质量管理(6)建立与健全研发项目代码编号管理制度,加强早期研发阶段的样品管理;(7)建立与完善研发培训体系。
引言
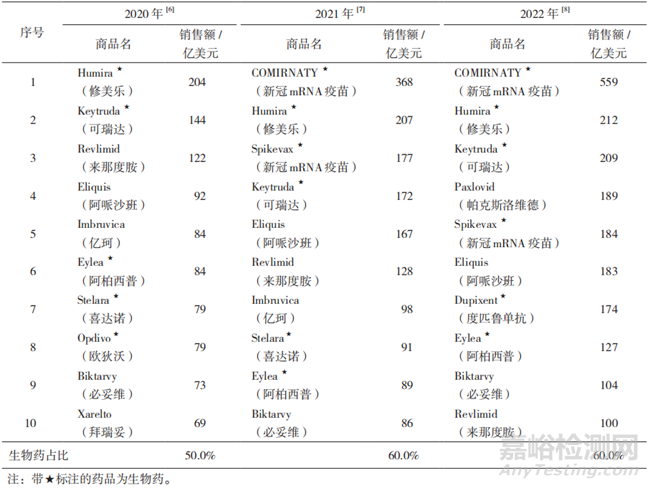
生物制品是指以微生物、细胞、动物或人源组织和体液等作为起始原材料,采用生物学技术制备,用于预防、治疗和诊断人类疾病的制剂,如疫苗、细胞因子、单克隆抗体、细胞与基因治疗产品、抗毒素及抗血清等[1-3]。与化学药品相比,生物制品成分多样、结构复杂,研发难度大,生产工艺条件要求高,现有分析手段不能完全表征其分子结构与特征[4-5]。同时,生物制品又具有给药剂量低、靶向性强、起效迅速、药效显著、安全性高、可以通过协同或拮抗作用发挥多效性、半衰期短、降解迅速等优势,这些优势都是化学药品难以企及的。2020-2022年全球前十名畅销药品中生物制品的占比均在半数或半数以上,且排在前两名的药品均为生物制品(见表1)。因此,成功研发一款生物制品具有极大的社会与经济价值。
▲表1-2020-2022 年全球畅销药品前十名汇总
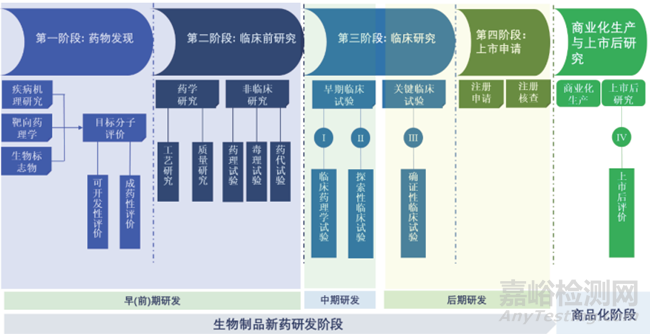
生物制品研发是一项周期长、投入大、过程复杂、风险高、专业技术性强的系统性工程,具有渐进性与不确定性的特点。在整个研发过程中,研发机构或企业将面临三重风险:技术性风险(早期研发失败或临床试验失败)、法规性风险(技术性风险与规范性问题叠加导致的注册申请失败)以及效益性风险(药品上市后的市场回报率未达到预期)。如图1所示,一款新生物制品在实现商品化生产与销售前,要经历药物发现、临床前研究(药学与非临床研究)、临床研究、上市注册申请4个阶段,其中由药物发现与临床前研究构成的早期研发结果直接决定了在研产品能否顺利实现首例人体用药,与安全性/有效性密切相关,是生物制品研发的基石。其中,生物制品早期研发的科学性、创新性与合理性,研究过程的真实性、准确性、完整性与可追溯性是药品注册申请的基础,是技术性风险与法规性风险的最直接体现,与药品研发质量管理工作密切相关。因此,在当前我国药品监管日趋国际化的大环境下,如何建立一套既有助于推进生物制品研发进度、提升研发效率,又能帮助研发机构/企业降低风险、提高研发成功率的研发质量管理体系,是生物制品研发机构/企业共同面临的巨大挑战[9-11]。
▲图1-生物制品新药研发流程图 [12]
本文汇总了我国现行与药品研发质量管理有关的法规,分析了法规要求与生物制品研发现状的契合度,根据生物制品早期研发阶段的特点,概括了早期研发过程中常见的研发质量管理问题,提出解决问题的对策与建议,供生物制品研发人员和企业参考。
一、 我国现行药品研发质量管理相关的法规
近年来,我国药品监管制度建设取得了巨大的成就,药品监管机构制定与颁布了多项可供药品研发质量管理参考的法规文件,相关的法规以及与研发质量管理有关的主要内容见表2。
▲表2-我国现行与药品研发质量管理相关的法规信息汇总
从表2可以看出,现阶段我国已颁布的法规中关于药品研发质量管理的规定主要涉及研发中后期阶段,对于研发早期阶段的质量管理,尚缺少明确、细致、可执行的法规文件。对于生物制品早期研发过程质量管理,机构与企业虽然可以参照上述现行规范与指南要求,如《药品生产质量管理规范》临床试验用药品附录,但这些法规文件的范围与法规条款并不完全适用于生物制品早期研发阶段,不能照抄、照搬。ICH Q9和ICH Q10指导原则作为《药品生产质量管理规范》的补充指南,阐述了质量风险管理理论,提出了贯穿药品全生命周期的药品质量管理体系,但这2份指南同样只是参考执行,不是强制性要求。
二、 生物制品早期研发过程中的常见质量管理问题
由于缺少明确的法规指导,导致生物制品早期研发阶段的研发质量管理水平参差不齐,出现了一些问题。如表3所述,生物制品早期研发过程中的质量管理问题主要表现为组织架构/人员设置、职能划分、管理制度、制度执行与培训、研究资料、物料和供应商管理以及样品管理7个方面的问题[13-22]。
▲表3-生物制品早期研发过程中的常见质量管理问题
三、 解决生物制品早期研发过程中常见质量管理问题的对策与建议
3.1 建立权责明确的生物制品研发质量管理部门
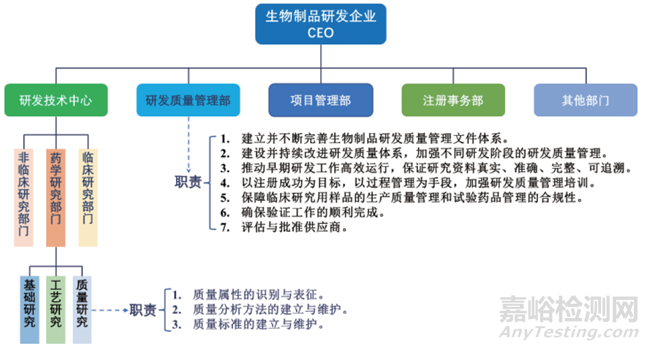
研发质量管理部门应独立于研发技术部门与注册部门(见图2)并赋予明确的授权和职责[14, 23]。
3.2 建立层次分明的生物制品研发质量管理文件体系
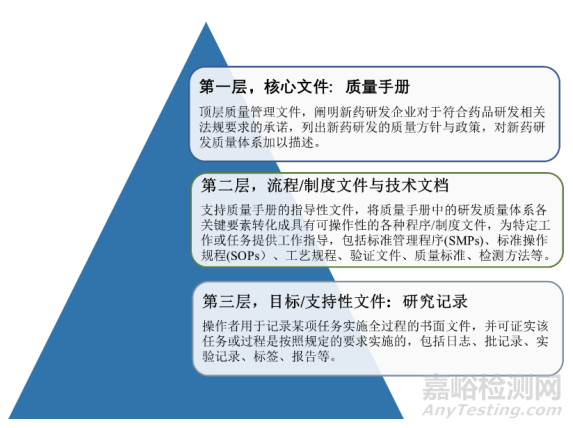
确保研发质量管理目标清晰、对象明确、途径清楚。生物制品研发质量文件体系的架构可采取三级或四级架构,以三级架构为例,其包含3个层次的文件(图3):第一层为质量手册,第二层为流程/制度文件与技术文档,第三层为记录类文件。另外,在制定制度文件时,应尤其注意几点问题:①应明确研发质量管理配套制度的适用范围为研发质量管理并采用专门的文件编号与版本号;②配套制度的制定是循序渐进、逐步完善的过程,无法一步到位;③应完整记录并真实反映配套制度的完善过程;④配套制度的更新与升级审批流程应相对便捷,避免流程冗余导致制度更新不及时。如表4所述,建立分类分层的研发质量管理文件体系,将使质量管理目标更加明确,有助于强化生物制品研发过程中的研发质量管理[23-24]。
▲图2-生物制品研发企业组织架构示意图
▲图3-生物制品研发质量文件体系架构图
▲表4-生物制品研发企业研发质量管理文件汇总
3.3 研发质量管理文件的制定应采取“纵横交错、贴合实际”的原则
横向管理可以将临床前药学研究的中试生产作为研发质量管理的分水岭,中试生产之前的研发过程以“确保清晰、完整、真实记录研发过程,推动研发进展”为宗旨,文件系统应与早期研发阶段“渐进性、多变性与灵活性”的特点相匹配;中试生产开始后则应适当遵循GMP要求,例如:预先制定生产计划、批准质量标准、建立合格供应商名单、物料入库前执行来料检验放行、实施验证的偏差与变更控制等。纵向管理则应根据不同阶段的研发条件与影响因素,针对性地分析可能对产品质量属性、研究资料真实性与可溯源性等产生影响的因素,对于高风险环节则应建立全面的质量控制措施。
3.4 加强质量管理工具的应用
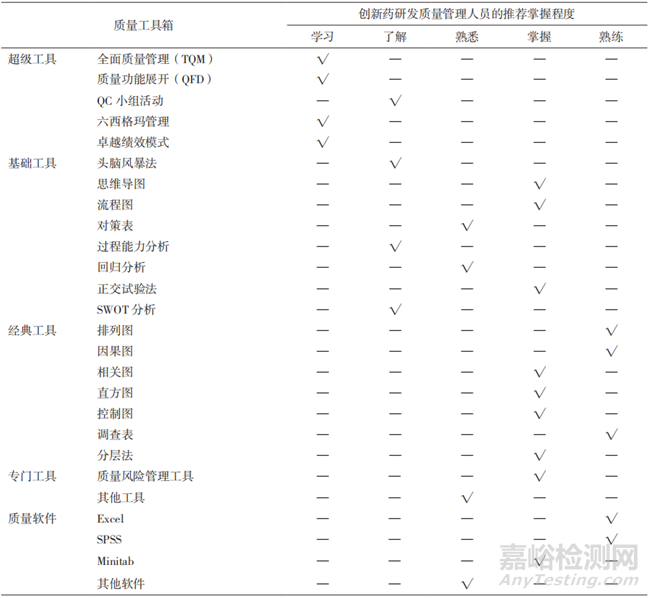
推进质量工具箱在生物制品研发质量管理中的应用。生物制品研发企业的质量管理人员应树立主动学习与掌握质量工具箱的意识,特别是加强“经典质量工具”在实际工作中的应用,熟练利用质量软件汇总、统计、分析研发质量管理数据,用先进的手段来发现与解决问题。表5中列出了生物制品研发质量管理人员推荐具备的质量工具箱使用技能要求[25]。
▲表5-质量管理工具矩阵示例及推荐生物制品研发质量管理人员应具备的技能
3.5 采取合理的管理模式
相较于药品生产管理模式高依从性、高重复性以及严格的变更控制,新药研发项目管理模式具有“灵活、渐进与可以不断完善”的优势,更符合生物制品早期研发阶段的需求。因此,生物制品早期研发质量管理应采取新药研发项目管理的模式,而非生产管理的模式,提高研发质量管理的创造性、创新性、灵活性与实用性(见表6)。
▲表6-药品研发项目管理与生产管理特征汇总表
3.6 建立与健全研发项目代码编号管理制度
制定并执行统一的项目编码规则;加强早期研发阶段的样品管理,建立研发样品登记、保存管理制度,保障样品的可追溯性,确保研发不同阶段的样品需求,特别是确保研发后一阶段对前一阶段样品的复检需求或补充检定需求。
3.7 建立与完善研发培训体系
研发培训应包含新员工入职培训、岗前培训和在岗技能提升培训。实施持续培训计划,包括法规更新培训、SOP/SMP更新培训、调岗再培训、知识技能提升培训以及关键技术岗位的定期培训等。建立考核制度,考核培训内容并评估培训效果,坚持培训合格再上岗[14,26-27]。
四、 结语
百年药企、研发先行,创新是根、质量为本,生物制品研发是生物制药企业长期发展的驱动力和核心竞争力,合理、完善的研发质量管理体系是保证生物制品研发与注册成功的基础。构建与运行药品研发质量管理体系,加强生物制品新药早期研发阶段的研发质量管理,降低企业在药品注册审评、核查与审批过程中的质量与合规风险,提高生物制品研发的规范性,将有助于生物制品的研发与上市。在这个过程中,研发企业要不断提升研发早期质量管理的理念,持续贯彻、改进、提高研发质量管理体系的运行水平,生物制品研发质量管理人员应正确履行职责,研发技术人员应提高质量意识,从而进一步激发生物制品研发企业的创造力与生命力,推动生物制品行业高质量的创新发展。
参考文献
[1] 王冠杰,邵明立. 从质量控制角度探索生物制品行业设备规范化管理[J]. 中国生物制品学杂志,2022,35(5):637-640.
[2] 国家市场监督管理总局. 生物制品批签发管理办法[S].2020.
[3] 颜若曦. 世界卫生组织生物制品检查要点与典型问题研究[J]. 中国医药工业杂志,2022,53(7):1049-1055.
[4] 李敏,郭秀侠,刘伯宁.关于生物制品工艺验证的审评实践与思考[J]. 中国生物制品学杂志,2017,30(6):664-672.
[5] 李敏,常卫红. 生物制品质量标准研究与建立一般原则的探讨[J]. 中国新药杂志,2017,26(16):1887-1893.
[6] Sagonowsky E. The Top 20 Drugs by Worldwide Sales in2020 [EB/OL].(2021-05-03)[2022-05-03]. https://www.fiercepharma.com/special-report/top-20-drugs-by-2020-sales.
[7] Dunleavy K. The Top 20 Drugs by Worldwide Sales in2021 [EB/OL].(2021-05-03)[2023-05-31]. https://www.fiercepharma.com/special-reports/top-20-drugs-worldwide-sales-2021.
[8] Buntz B. The 50 Best-selling Pharmaceuticals of 2022:COVID-19 Vaccines Poised to Take a Step Back [EB/OL]. (2023-04-18)[2023-06-05]. https://www.drugdiscoverytrends.com/50-of-2022s-best- selling-pharmaceuticals/.
[9] 康建磊,王亚敏. 创新药药学研究的特点及技术考虑[J].药物评价研究,2016,39(4):664-667.
[10] 杨志敏,冯毅. 创新性药物研发失败原因的探讨[J]. 中国新药杂志,2010,19(1):17-19.
[11] 徐春柳,蒋琴南. 制药企业药品研发阶段质量管理存在的问题及对策探讨[J]. 化工管理,2020(6):43-44.
[12] Wagner J, Dahlem A, Hudson L, et al. Application of aDynamic Map for Learning, Communicating, Navigating,and Improving Therapeutic Development[J]. Clin TranslSci, 2018,11(2):166-174.
[13] 杜晓霞,邢花.制药企业药品研发阶段质量管理存在的问题及对策探讨[J]. 中国药物评价,2018,35(3):230-232.
[14] 赵艳梅,韩昆,由春娜,等. 完善制药企业药品研发质量管理体系的探讨[J]. 中国药事,2019,33(8):896-903.
[15] 张莹,舒璐俊. 制药企业药品研发阶段质量管理存在的问题及对策探讨[J]. 临床医药文献电子杂志,2019,6(78):194.
[16] 葛旭. 制药企业药品研发阶段质量管理存在的问题及对策[J]. 医药化工,2021,47(1):165-166.
[17] 祝翠红,邢靓. 制药企业药品研发阶段质量管理研究[J]. 医药化工,2020,46(1):219.
[18] 胡小娟,曹轶. 化学药品药学研制现场核查常见问题分析[J]. 中国新药杂志,2023,32(8):783-786.
[19] 杜婧,高胜男. 药品注册核查中对技术转移方面的探讨[J]. 中国新药杂志,2022,31(17):1684-1688.
[20] 颜若曦,曹轶,董江萍. 药品注册核查中对数据管理要求的研究[J]. 中国新药杂志,2022,31(2):160-164.
[21] 汪丽,胡春丽,沈文娟. 药品注册研制现场检查中的问题及对策建议[J]. 中国药业,2018,27(24):100-104.
[22] 周莉婷, 白玉. 中国生物制品实施ICH M4Q指导原则的思考[J]. 中国生物制品学杂志,2020,33(9):1083-1087.
[23] 程英,汪飞,刘超,等. 药物研发全过程质量管理体系的构建和运行[J]. 中国药事,2021,35(6):631-640.
[24] 李孙华,王士义,李丽洁,等. 生物制品研发机构质量管理体系的构建策略[J]. 中国当代医药,2015,22(21):137-139.
[25] Nancy R. Tague. 质量工具箱[M]. 第二版 何桢,施亮星,译. 北京:中国标准出版社,2007.
[26] 伊娜. 药品研发质量管理体系分析和应对方法[J]. 黑龙江医药, 2021, 34 (3):561-563.
[27] 马丽媛. 放射性药品研发质量管理体系建设思考[J]. 现代企业文化,2022(10):49-51.