由于生物类似药和一般化学仿制药存在多方面的差异,生物类似药的立项除遵循一般化学仿制药立项需考虑的要素和原则外,还需要关注生物类似药的产品复杂性、监管不确定性以及研发周期长、成本高等要素和特点。
1、产品定位策略
目前,欧美成熟市场与新兴市场中生物类似药领域的竞争日趋激烈,研发热点已经从结构简单的重组蛋白药物转向了单抗、融合蛋白、胰岛素类似物等结构复杂的生物药,尤其是阿达木单抗 (adalimumab)曲妥珠单抗 (trastuzumab)、利妥昔单抗 (rituximab)、英夫利昔单抗 (inliximab) 等单抗类重磅产品在国内,针对TNF-a、ECFR、VEGF、HER2 等热门点的单抗或融合蛋白类生物类似药品种出现了扎堆申报现象,这可能会导致后续的同质化和过度竞争的问题,使进度落后的企业的投资回报达不到预期。因此,不同企业要根据自身的优势聚焦有市场优势的疾病领域,避免选择过度热门的靶点。另外,在研发立项之初,制定面向全球目标市场的开发策略尤为重要。例如,国内也有企业的贝伐珠单抗生物类似药已在中国和美国同时开展临床试验,采用了在当前中国为数不多的“中美双报”注册策略。
2、市场竞争
生物类似药除与原研厂商争夺市场外,同时面临着同品种多个厂家的扎堆研制和竞争。另外,还需要考虑以下其他两类品种的竞争。
一类是在历史时期未按照生物类似药监管途径与原研产品进行质量、安全性、有效性的严格比对试验,或未能验证与原研产品具有高度生物相似性,在质量和成分上有差异,不能互相替代的仿制产品(Imitator)。2015 年国家食品药品监督管理总局 (CFDA)《生物类似药研发与评价技术指导原则(试行)》出台之前,国内有不少此类按新药途径申报的仿制产品,如依那西 (etanercept) 的国内仿制产品益赛普 (三生国健)、强克 (上海赛金) 和安百诺(海正药业)。
另一类是改良型创新生物药 (bio -better),是对已上市的原研生物药进行长效化、靶向性、多能性(多靶点)、给药途径改良等方面的升级,与原研生物药及生物类似药相比具有更佳的安全性有效性或患者依从性等临床优势。原研厂商通过对原研药做进一步的改良,在原研药专利截止之际,
推出改良型的生物新药,以维持其产品在市场中的领先地位,如罗氏的抗体偶联药物 (amtibody -drugconjugate,ADC)曲妥珠单抗-美坦新 (trastuzumab emtansine,Kadcyla)、皮下注射剂型利妥昔单抗/透明质酸酶(rituximab/hyaluronidase,Rituxan Hycela)、皮下注射剂型曲妥珠单抗/透明质酸酶 (trastuzumab/hyaluronidase -oysk,Herceptin Hylecta)。在国外,皮下注射剂可缩短注射时间、降低病床占有率,同时减少对医护人员的使用,进而降低医疗费用,因而对同一药品的静脉注射剂型类似药带来明显挑战
另外,原研药厂商还会采用授权品牌生物类似药的方式,以应对生物类似药的冲击。例如,罗氏为应对 DrReddy制药公司的利妥昔单抗 (rituximab) 生物类似药 Reditux 上市对其原研药 Rituxan的冲击,与印度本土药企Emcure Pharmaceuticals 合作,在当地生产第二个Rituxan 品牌生物药,以低价与生物类似药Reditux竞争。
3、监管政策
监管机构对生物类似药的监管政策仍处于发展变化阶段,部分市场缺乏一致和清晰的注册、监管路径。欧盟 EMA 最早开始建立生物类似药监管体系 (2001年),并逐渐形成了目前最为系统和完备的法规和监管体系。美国FDA 于2012 年发布了生物类似药指导原则,且已批准了一些生物类似药品种目前,相应的法规、指南和注册审批体系还在完善之中。中国药品监管部门于 2015 年颁布了《生物类似药研发与评价技术指导原则(试行)》,标志着中国生物类似药产业的启动,之后,相关品种的开发指南也陆续发布:其他相关的法规指南正在完善中,这将逐渐减少研发监管的不确定性。
另外,在中国,其他行政制度也影响着生物类似药的研发。例如,医保控费压力增加将鼓励生物类似药研发,以提高药品的可及性;国内上市许可人 (Marketing Authorization Holder,MAH) 制度的实施也扩大了生物类似药的合同生产外包 (Contract Manufacture 0rganization,CMO)市场,推动了药品的研发。
各国和地区政府对于生物类似药可互换性要求的不一致性也是立项过程中需要认真考虑的问题。生物类似药具有大分子结构,这决定了其难以做到与参照药完全一致进而实现临床使用的完全互换。许多国家通过立法,明确了生物类似药使用和互换的要求。目前,只有美国确定了生物类似药可互换产品的定义,并对其提出了额外的技术要求,要求提供可以证明生物类似药与参照药转换使用没有临床意义差异的额外临床数据。欧盟的“可互换”概念是由医生决定是否用某种具有相同治疗目的的药物替代另一种药物,即转换(switching)。医生通过对生物类似药的了解并结合患者的疾病发生发展情况,给予其合适的生物类似药。我国尚未建立可互换生物类似药的定义和额外的技术标准,目前主要由临床医生根据患者和生物类似药的特点开具处方。理论上,对原研生物药产生积极反应的患者可以接受相应的生物类似药,从而降低治疗成本。经过多年使用,主要监管机构对于生物类似药可互换性的有效性和安全性(主要是免疫原性和治疗活性)的担心已经大大减少,尽管如此,各监管机构的立场尚未达到一致。这就要求在项目立项时,应根据不同监管机构对于可互换性的要求确定研究策略。
4、产品特性
生物类似药具有分子量大、结构高度复杂的特点,因此,其开发涉及多个层次的复杂过程,包括需高度受控的制造工艺开发、临床前结构与功能和生物学活性评估、临床疗效和安全性(包括免疫原性)分析等。为确保与参照药的高度相似性,应在生物类似药开发的每一步开展与参照药的头对头比对试验,以证明其在质量、安全性和疗效方面与参照药没有临床意义上的差异。
生物类似药开发的总体思路是以证明其与参照药具有相似性的比对试验为基础,支持生物类似药的安全、有效和质量可控。应采用逐步递进的顺序,分阶段开展药学、非临床和临床比对试验。监管机构正是基于这一全面、逐步递进的比较相似性研究的综合证据 (totality o evidence) 来决定是否批准生物类似药的上市许可,
与化药仿制药相比,生物类似药的开发难度更高、生产工艺更为复杂、研发周期更长,因此研发成本也更高。此外,在市场推广方面,生物类似药需要更专业的医生和患者教育以及更高的市场准入门槛。二者的主要特点对比见表 2 -1。
下面将以抗体药物的研发为例,从工艺、质量评价、临床等几个方面来说明产品复杂性对于生物类似药立项考量的影响。
4.1复杂性
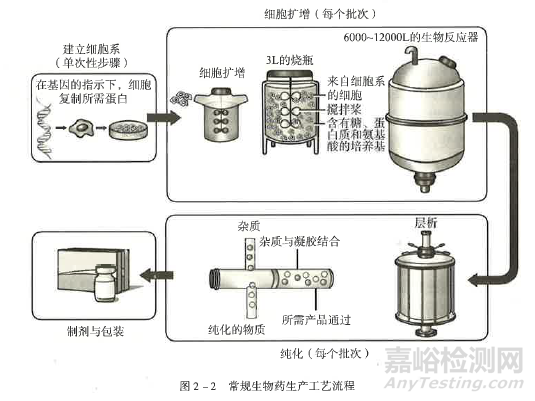
生物类似药的制备工艺同创新生物药、原研生物药(参照药) 一样,涉及独特、昂贵且耗时的操作。生物类似药是利用生物合成的大分子药物,使用在良好控制条件下培养的活细胞系 (工程细胞株)进行表达制备。因此,生物类似药工艺开发的第一步是开发含有目的蛋白基因的工程细胞株,保证目的基因能够高效率表达目的蛋白且具有所需的翻译后修饰。在获得工程细胞株之后,常规的生物类似药生产工艺包括3 个方面:①细胞扩增和蛋白表达;②蛋白分离和纯化;③制剂和包装。为增加产量、提高生产效率、降低风险、保证产品质量和安全性,一次性生物工艺、连续流生产工艺以及模块化工厂等新型工艺技术和设施得到应用,使生物类似药生产工艺具有更强的可行性 (图2-2)。
生物类似药生产工艺的复杂性,决定了整个生产工艺需严格受控,因为工艺过程中的微小变化可能会导致最终产品的临床有效性、安全性 (包括免疫原性) 发生改变。另外,如果产品生产过程或储存过程引起糖基化、脱胺、异构化、氧化或产生聚集体等产品相关蛋白或杂质的变化,也可能会影响单抗的结构和抗原结合特性。因此,需对生物类似药生产工艺过程进行严格控制和监测,以保证产品的全部质量属性(包括一级结构、高级结构或构象以及翻译后修饰等特性) 的批间一致性。同时对参照药及其制备工艺的深刻理解有助于实现生物类似药与其在物质基础上的药学相似性。质量源于设计 (QbD) 的理念和原则逐渐被业界应用于生物类似药的开发,以一种科学的、基于风险的、主动的、系统的药物开发方法,促进对产品及其生产过程的理解,从而使设计出的生物类似药能够满足预期的临床性能,并且能够生产出一致的、持续满足临床所需质量属性的产品。
生物类似药本身是一种生物制剂,因此,所有与批准生物制剂有关的 CMC 方面的要求都适用于生物类似药,除此之外,还有一个更为重要的要求一一与参照药的相似性要求。也就是说,生物类似药开发商不仅需要通过最相关的、最先进的方法证明其产品本身能够保持一致的质量,而且必须证明其与参照药足够相似。由于不可能完全重现参照药的生产工艺,可能会引起产品的糖基化和其他翻译后修饰,造成产品异质性(包括C 末端均一性、产品相关蛋白或杂质的不同等),生物类似药开发商还需证明这些不同不会使生物类似药与其参照药在安全性和有效性方面有临床意义上的差别。
4.2产品质量评价
生物类似药开发的第一步是建立生物类似药的目标质量属性 (target quality attribute,TQA)。显然,TOA 是由参照药的特性定义的,而生物类似药开发的目标是使其质量属性尽量与 TOA 高度相似因此,使用最先进的正交分析工具对参照药进行详细的表征 (包括识别批间变异性和杂质),是进行生物类似药开发的先决条件。为确定参照药的变异范围,需对参照药多批次产品进行测试。确定生物类似药TOA 的主要考虑因素包括:了解哪些质量属性对其生物学活性和临床疗效是重要的,如单抗的质量属性包括但不限于氨基酸序列、纯度、聚合体、电荷异质性、高级结构、翻译后修饰(包括糖谱)和生物学活性。@如果参照药存在多种作用机制 (mechanism o ation,MOA) 和适应症,则应了解具体适应症的 MOA 和每个 MOA 的目标质量属性。
如前所述,生物类似药开发的成功与否取决于一个逐步递进的过程。在这个逐步递进的开发过程中,产品质量分析数据(包括理化特性、生物学活性、纯度和杂质、免疫学特性等) 所显示的相似性水平会影响临床前和临床部分的开发。在产品质量特征(物质基础) 上尽可能与参照药保持一致,可能会减少监管上对临床数据的要求。因此,在广泛的产品质量分析特征基础上展示出高水平的相似性是生物类似药非临床和临床研究的基础,并可决定后续非临床和临床研究的内容是否可以简化。
产品质量特性的改变,如序列变异、分子结构的细微变化、产品相关杂质 (氧化、脱氨基、聚集体、降解产物)、工艺相关杂质(如宿主细胞蛋白、其他工艺污染物 等,均有可能引起产品免疫原性变化,进而影响其药动、药代性质,并进一步影响生物类似药的疗效和安全性。尤为重要的是,生物类似药给药后机体产生的抗药抗体 (anti- drug atbody,ADA)可能会中和药物的活性,影响药物的清除、血浆半衰期和组织分布,变其药效动力学 (PD) 特征。因此,应采用与参照药一致的技术和方法来开展非临床和临床的免疫原性比对试验研究。
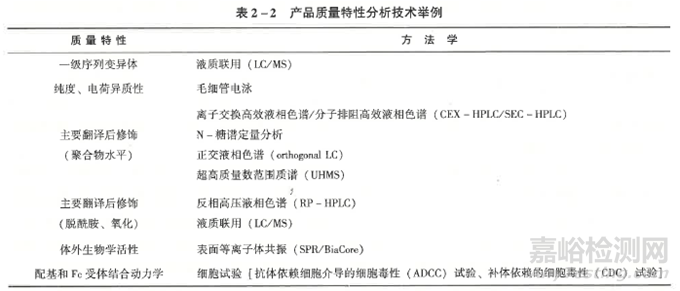
在产品质量特性分析比对试验研究中,应对样品质量的批间差异进行分析,选择有代表性的批次进行试验。研究中,应尽可能使用敏感的、先进的分析技术和方法检测候选药(生物类似药) 与参照药之间可能存在的差异。还应根据参照药的信息,评估每一个质量特性与临床效果的相关性,并设立判定相似性的限度范围。对特性分析的比对试验研究结果进行综合评判时,应根据各质量特性与临床效果的相关程度评判相似性的权重,并设定标准。产品质量特性分析比对试验包括(但不限于) 以下蛋白结构特性及翻译后修饰特性的比较研究:①一级结构,即氨基酸序列;②高级结构,包括二级三级、四级结构(适用时);③翻译后修饰,如糖基化、磷酸化等 (适用时);④产品相关物质,如蛋白脱胺化、氧化等(表2-2)。
4.3临床试验及适应症外推
临床试验作为生物类似药相似度评估的最后一步,其目的是确认生物类似药在临床安全性和有效性方面与参照药是否高度相似并解决任何残留不确定性 (residual uncertainties)问题。一旦生物类似药展示出与参照药在产品质量特征分析中的相似性,生物类似药开发商就可以部分依赖于参照药的质量安全性和有效性的临床数据,而不必从头开展证明安全性和有效性的确证性临床。由于生物类似药的使用剂量和给药方案与参照药相同,生物类似药开发商也无须开展剂量探索的前期临床试验。Schneider 等人将生物类似药临床试验的基本原则总结如下。①第一步必须包括 PK 和 PD 的头对头比较。②至少采用一项充分的、随机的、平行对照的临床试验,最好是双盲设计,用以比较生物类似药和参照药的有效性和安全性。③采用参照药建议的剂量,以展示生物类似药临床疗效的等效性 (既不是非劣效也不是非优效)。④以确认相似性为目标,应选择对于检测相关产品质量差异 (如果存在的话)最敏感的人群进行临床试验。⑤临床方案的设计应与各研究阶段支持可比性的逐步递进的比对试验中获得的证据水平相适应。
生物类似药与参照药的等效性比对试验研究,由于比较、确认的特性,其通常所需病例数小于原研创新药的I期临床研究(确证性临床) 的病例数。
在生物类似药临床疗效比较研究中,需要合理选择比值或差值作为主要终点指标的效应量。等效性界值一般基于参照药疗效的置信区间进行估算,并结合临床意义进行确定。参照药的疗效通常依据参照药与标准治疗(或安慰剂)随机对照优效性研究的 Meta 分析结果来确定。纳入 Meta 分析文献的选择、分析结果的利用等,需要综合考虑目标适应症的国内外临床实践、种族差异、样本量可行性等因素。
对于经过等效性比对试验研究证实临床相似的生物类似药,可以考虑外推至参照药的其他适应症该外推的适应症,应当是临床相关的病理机制和(或)有关受体相同,且作用机理、靶点是相同的。另外,临床比对试验应选择合适的适应症,并确保对外推适应症的安全性和免疫原性进行了充分的评估。尽管如此,也有专家担心一种生物类似物对一种适应症有效的临床证据并不一定意味着这种药物对另一种适应症有效。虽然这些争议的声音正在减弱,但还是需要在项目立项时进行充分评估。