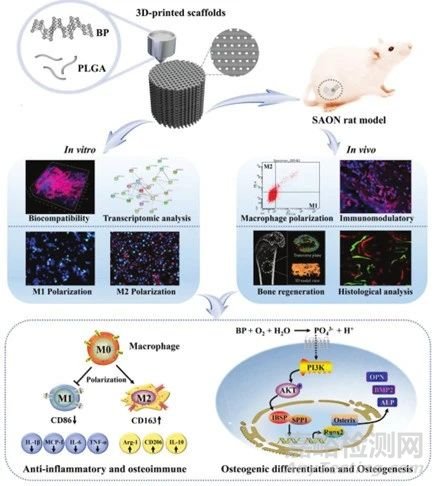
近年来,随着生物材料的发展,3D打印支架形式的生物材料在骨再生研究中得到了广泛的应用。由于其个性化设计和良好的生物相容性,可以通过提高手术准确性和安全性来加速骨再生。当生物材料激活再生系统时,生物材料与免疫系统之间的相互作用反应是不可避免的。因此,骨替代生物材料的开发应促进成骨分化,并注重诱导适度的骨免疫微环境。
近日,来自中国科学院深圳先进技术研究院的赖毓霄研究员团队利用低温3D打印技术开发了聚(乳酸-乙醇酸)(PLGA)掺入黑磷(BP)纳米片支架(PLGA/BP支架),以满足各种成骨材料结构的特殊要求(方案1)。PLGA/BP支架表现出适当的生物相容性、生物可降解性和机械性能,作为支持新骨形成的优异微环境。通过细胞学、免疫组化等手段对BP骨免疫调节和成骨的影响进行了详细的探究(方案1)。
相关研究成果以“Regulation of Osteoimmune Microenvironment and Osteogenesis by 3D-Printed PLAG/black Phosphorus Scaffolds for Bone Regeneration”为题于2023年8月24日发表在《Advanced Science》上。
方案1 3D打印制造的PLGA/BP支架示意图以及BP降解诱导骨免疫环境加速骨再生的机制
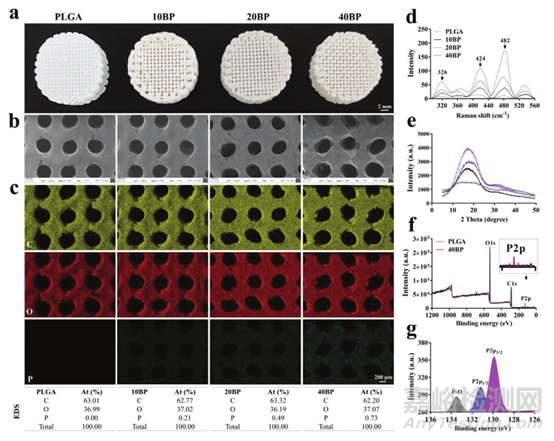
1. 3D打印BP纳米片作为支架的制造和表征
该研究利用低温沉积3D打印技术来制造PLGA/BP支架,可生物降解聚合物PLGA用作形成复合支架的基质,将不同量的BP纳米片添加PLGA基质中在-30 ℃下打印(图1a)。利用低温3D打印技术调节支架的孔隙率,使PLGA/BP支架具有大孔和微孔的高互连性,可以增加骨传导性,促进骨细胞增殖及其与细胞外基质的粘附。SEM表明支架具有良好的互连结构,平均大孔横向尺寸为408.69±29.76 μm,支架表面微孔横向尺寸为1- 50 μm(图1b)。EDS进一步表明磷元素在骨架中的比例随着BP含量的增加而增加(图1c)。作者还利用拉曼、XRD和XPS证实了BP纳米片成功引入PLGA支架中(图1d-g)。
图1 3D打印支架的形态和表征
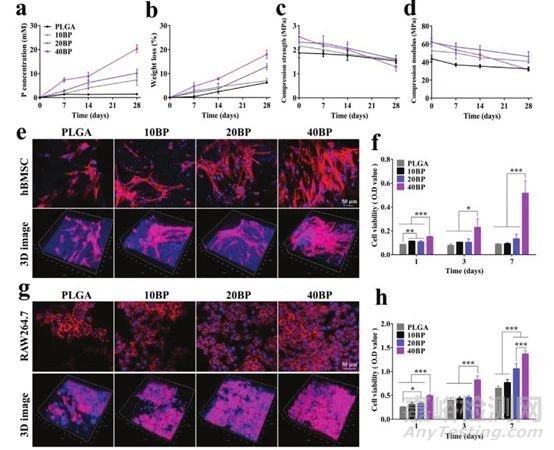
2. PLGA/BP支架的体外研究
随后作者研究了PLGA/BP支架的降解性。BP纳米片可以缓慢降解并连续释放磷酸分子长达28天(图2a),并且PBS中的P元素浓度也不断增加。PLGA/BP支架的最终降解产物是无毒的磷酸盐和乳酸。PLGA/BP支架在指示降解时间点的抗压强度和抗压模量的变化如图2c、d所示。力学测试表明,在为期4周的降解过程中,不同PLGA/BP支架的机械性能在所有组中均呈现下降趋势。此外,作者培养三种不同浓度的PLGA/BP支架7天后进行鬼笔环肽的荧光染色。实验结果表明支架上粘附有大量的hBMSC或RAW264.7细胞以及丰富的细胞骨架,证明了该材料良好的生物相容性。总的来看,PLGA/BP支架还具有合适的生物相容性、生物可降解性和出色的机械性能,是骨缺损治疗的理想选择。
图2 不同BP浓度PLGA/BP支架的体外降解行为及生物相容性测试
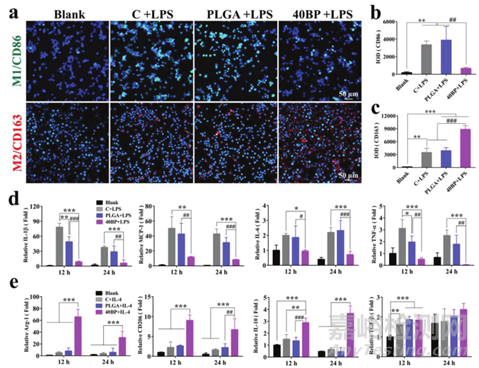
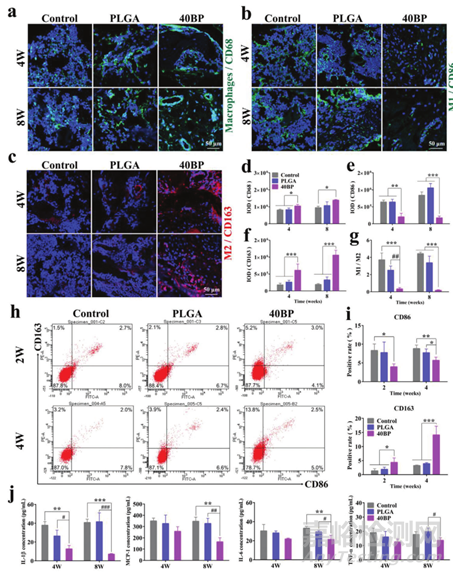
初始炎症阶段比随后的活跃骨修复阶段更为重要,巨噬细胞在控制炎症反应和维持骨再生过程中发挥着决定性作用。因此,作者首先在体外研究了不同支架上巨噬细胞的极化。使用免疫荧光染色和共聚焦显微镜定性评估了不同的PLGA/BP支架如何影响巨噬细胞响应LPS刺激的极化。巨噬细胞典型的表面标志物在不同基因型中存在差异表达,CD86被发现在促炎巨噬细胞阶段(M1)强表达。M2表型由典型表面标记CD163激活,有助于下调炎症并增强组织愈合。(图3a-c)。与LPS刺激的对照组相比,PLGA组CD163表达的荧光强度相似。这表明PLGA/BP支架可以促进M1型巨噬细胞向M2型巨噬细胞的转化。
此外,在相同培养条件下检测12和24小时抗炎细胞因子的分泌,以证实不同材料对细胞的影响。结果表明PLGA/BP支架可以招募巨噬细胞并抑制炎症,从而刺激巨噬细胞的M2极化并促进骨再生。
图3 PLAG/BP支架上的巨噬细胞极化
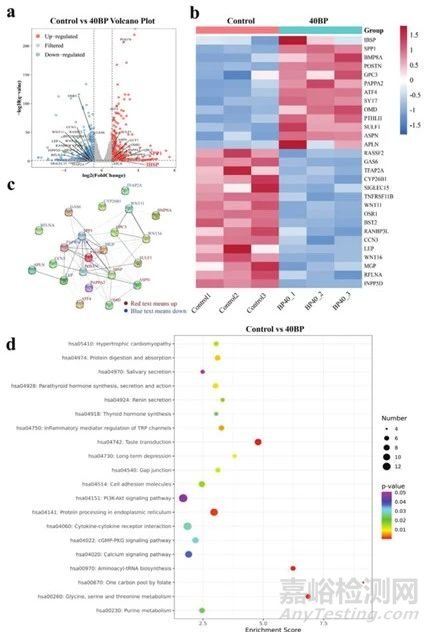
为了进一步研究BP对成骨分化和矿化的分子机制,对在降解释放浸出的PLGA/BP支架上培养的hBMSC进行了转录组分析(图4a-b)。本节的结果(图4c)表明BP最有可能在骨基质形成中发挥积极作用。而且KEGG数据库分析结果(图4d)显示细胞粘附分子、内质网蛋白加工、cGMP-PKG信号通路、PI3K-AKT信号通路,这些与组织损伤修复相关的信号通路显着上调,而且PI3K-AKT也显着上调,信号通路可能有助于维持巨噬细胞M2极化。
图4 PLGA/BP 支架成骨分化的转录组分析
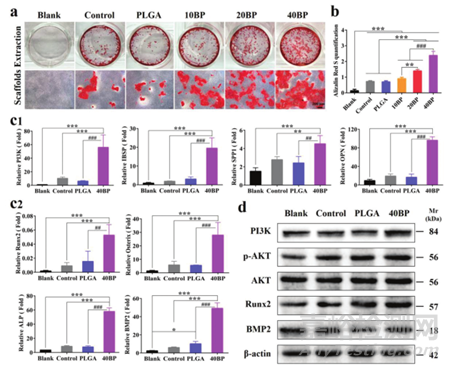
通过钙结节染色的半定量分析评估不同PLGA/BP支架组的成骨分化水平。成骨诱导第14天,观察到支架提取物诱导的hBMSC细胞在各实验组均出现不同程度的深红色钙沉积(图5a),尤其是40BP提取物培养后钙沉积密度最大(图5b),表明40BP支架更有效地促进成骨分化。为了进一步评估成骨分化过程中相关基因的表达情况,检测并验证了转录组相关筛选基因(PI3K、IBSP、SPP1、OPN,图5c1)和成骨相关基因(Runx2、Osterix、ALP、BMP2,图5c2)。对于成骨中的功能蛋白,与对照组和PLGA组相比,40BP组的Runx2表达也显着上调(图5d)。转录组分析结果与成骨分化实验结果一致,提示40BP支架可通过PI3K-AKT信号通路促进成骨细胞蛋白分泌、成骨分化和成骨行为。
图5 PLGA/BP支架通过激活PI3K-AKT信号通路促进成骨分化和矿化
3. 支架在体内的成骨研究
体外数据结果表明BP在体外诱导巨噬细胞M2极化并抑制炎症以协调骨再生,作者还进一步利用SAON大鼠模型研究了其免疫调节功能。通过对大鼠股骨切片上不同实验组的巨噬细胞进行了免疫荧光染色展示各组单核巨噬细胞CD68免疫荧光表达情况(图6a-d)。统计结果显示PLGA和40BP支架均可招募M2巨噬细胞(图6d)。免疫荧光结果进一步证实PLGA/BP支架可以诱导巨噬细胞M1(CD86)向M2(CD163)极化。BP可以调节大鼠植入部位周围的骨免疫环境。40BP组能有效促进体内M2巨噬细胞表型、降低M1巨噬细胞表型,对抗炎局部微环境中新骨形成产生积极影响。
图6 PLGA/BP支架对SAON大鼠股骨远端缺损免疫调节作用的体内评估
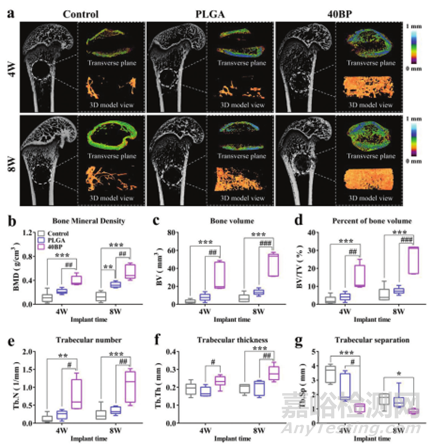
最后将40BP支架植入SAON大鼠模型的股骨远端缺损来评估其成骨效果。术后4周和8周,通过微型CT扫描骨缺损部位并重建以进行分析(图7a)。术后4周各组支架均无松动、脱落,缺损腔内开始长出新骨组织。术后8周,空对照组和PLGA组手术腔内外新生骨逐渐增多,但与40BP组不同的是,仍未完全恢复。骨生长定量分析如图7b-g所示,包括骨密度(BMD)、骨体积(BV)、骨体积百分比(BV/TV)和骨小梁分析。综合信息表明BP支架表现出优异的成骨和骨整合能力,证明骨免疫微环境促进成骨和骨再生过程。
图7 micro-CT检测骨缺损中PLGA/BP支架对新骨形成的作用
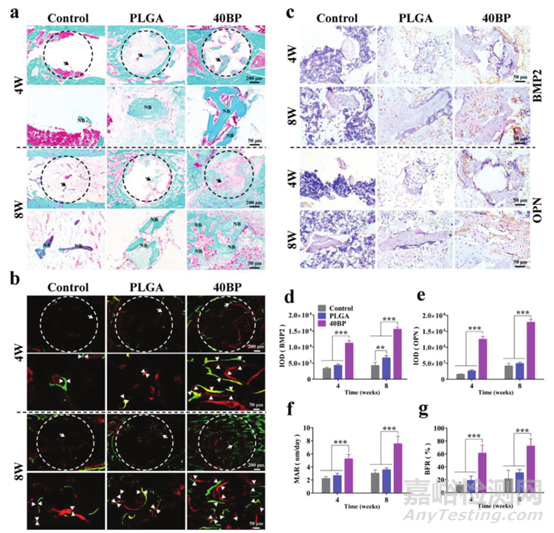
为了评估新骨组织的生长和骨-种植体界面的整合效果,在对照组、PLGA和40BP组中进行了Goldner三色染色(图8a)和H&E染色。在40BP组中,通过染色检测到大量矿化骨组织(绿色)。为了进一步分析骨再生,通过免疫组织化学染色检测与骨生成相关的蛋白质(BMP2、OPN和OCN,图8c)。支架植入后4周和8周,与成骨相关的40BP蛋白表达较对照组和PLGA组显着增加(图8d,e),表明40BP支架具有优异的骨再生能力。
为了研究新骨形成和重塑的效果,在不同时间点用连续荧光标记对矿化骨组织进行标记。使用荧光图像(图8b),定量分析发现40BP组的矿物质沉积率(MAR,图8f)和骨形成率(BFR,图8g)显着增加,骨组织的形成和修复速度明显高于对照组和PLGA组,表明植入40BP支架后骨组织形成和修复加速。这些组织学数据表明40BP支架可以显着改善新骨的形成,达到对骨缺损的有效治疗效果。
图8 术后4周和8周SAON大鼠股骨远端缺损区域新骨形成的组织学分析
综上,本文利用多孔PLGA/BP支架的3D打印来研究BP对骨组织微环境乃至随后的骨再生的骨免疫调节作用。多孔PLGA/BP支架可以显着抑制炎症细胞因子并促进巨噬细胞极化至M2型。在体内,这种促成骨微环境通过上调IBSP、SPP1、ALP、Osterix、OPN、R2和BMP2来促进hBMSC的增殖和分化,从而进一步加速骨再生。此外,PLGA/BP支架具有优异的成骨性、生物相容性和力学性能,可以通过PI3K-AKT信号通路有效促进骨再生。因此,PLGA/BP支架是一种优良的骨替代物,可用于通过免疫调节原位骨和成骨来治疗骨缺损。
文章来源:https://doi.org/10.1002/advs.202302539