今日头条
锐明小分子VEGF抑制剂I期临床积极。苏州锐明新药宣布,该公司自主研发、针对新生血管性(湿性)年龄相关性黄斑变性(wAMD)的滴眼剂RA1115-B1,在健康受试者中开展的I期临床中获得安全性数据,具有良好的耐受性和药代动力学特征。RA1115-B1是一款VEGF抑制剂,可阻断VEGFr-2的磷酸化并抑制VEGF诱导下的内皮细胞的粘附、增殖和迁移,减少病理性血管增生,进而减轻渗漏、出血对视网膜的影响,以达到改善视力的效果。
国内药讯
1.安斯泰来AR抑制剂中国Ⅲ期临床成功。安斯泰来雄激素受体(AR)抑制剂恩扎卢胺联合雄激素剥夺疗法(ADT)治疗转移性激素敏感性前列腺癌(mHSPC)男性患者的中国Ⅲ期研究ARCHES达到主要终点和关键次要终点。与安慰剂联合ADT相比,恩扎卢胺联合ADT治疗显著改善患者至前列腺特异性抗原(PSA)进展时间(TTPP);显著降低影像学无进展生存期(rPFS)的风险,使患者PSA不可测水平比率增加。而且药物的安全性与已知研究一致。
2.众生睿创长效GLP-1类药物获批临床。众生药业旗下众生睿创研发的1类新药RAY1225注射液获国家药监局临床试验默示许可,拟开发用于治疗2型糖尿病、超重或肥胖。RAY1225是一款GLP-1/GIP双重激动剂,可通过刺激胰岛素分泌、延缓胃排空等机制调节人体代谢和控制血糖。在临床前研究中,RAY1225对GLP-1和GIP受体均有较高的激动活性,并在试验动物体内显示出良好的药效和安全性。
3. 德琪Claudin 18.2靶向ADC国内获批临床。德琪医药靶向Claudin 18.2的抗体偶联药物(ADC)ATG-022获国家药监局批准开展Ⅰ期临床,针对适应症为晚期及转移性实体瘤(Claudin 18.2阳性表达)的治疗。德琪医药在AACR 2022会议上发布的数据显示,ATG-022对于Claudin 18.2有低纳摩尔级别的高亲和力,并具有强效的体内和体外抗肿瘤活性。此外,ATG-022还在Claudin 18.2低表达的病人来源胃癌异种移植模型中显示出较对照药物更为强效的抗肿瘤活性。此前,该新药已在澳大利亚获批临床。
4.上海惠和CD19/3/28三抗国内获批临床。惠和生物I类生物药CC312冻干粉针剂获国家药监局临床试验许可,适应症为复发/难治性CD19阳性B细胞恶性血液肿瘤。CC312是国内首款靶向CD19/CD3/CD28三特异性抗体,以“双信号”调控机制活化T细胞,对效应细胞的激活作用更持久,并可诱导T细胞分化成记忆性T细胞,延长药物的作用时间,改善临床给药模式。2022年5月,FDA已批准该药在美国开展临床试验。
5.丹诺抗幽门螺杆菌新药在美获批临床。丹诺医药多靶点偶联分子瑞法舒坦唑(TNP-2198)获FDA批准,即将在美国开展用于治疗幽门螺杆菌感染的临床研究。TNP-2198由利福霉素和硝基咪唑两个药效团通过稳定的共价键形成,对厌氧菌和微需氧菌具有独特的抗菌活性。此前,丹诺医药已在国内完成5项临床试验,适应症包括幽门螺杆菌感染相关性消化道疾病、细菌性阴道病和艰难梭菌感染相关性腹泻。
国际药讯
1.布地奈德IgA肾病Ⅲ期临床成功。Calliditas公司布地奈德(Tarpeyo)缓释胶囊用于治疗原发性免疫球蛋白A(IgA)肾病的Ⅲ期试验B部分数据积极。患者在经过9个月布地奈德治疗与之后15个月停药随访共两年期间,与安慰剂组相较,药物组患者在eGFR(估计肾小球滤过率)值上显示具显著益处(p<0.0001),达到主要终点指标。该项试验的长期数据有望支持布地奈德的完全批准申请。
2.视神经病变基因疗法Ⅲ期临床积极。GenSight Biologics基因疗法Lumevoq治疗遗传性视神经病变(LHON)的Ⅲ期临床(REFLECT)3年随访结果积极。与接受单眼治疗的患者相比,接受双眼注射的患者多看到6.5个ETDRS视力表字母,且基线最低点视力相较时,两眼则分别多看见+17至+20个字母。试验中没有观察到任何因系统性或眼睛相关不良反应而须停止试验的事件。在欧盟,该新药正接受EMA的监管审查。
3.赛诺菲29亿美元收购Provention公司。赛诺菲将斥资近29亿美元收购Provention,并囊获该公司已获FDA批准上市的首款能延缓1型糖尿病(T1D)发作药物Tzield(teplizumab)。Tzield是一款抗CD3单抗,它能够使接受2周疗程治疗的患者的T1D的发病时间平均推迟约3年(中位数为32.5个月)。除Tzield之外,赛诺菲还获得Provention在临床前或临床试验中获概念性验证的自身免疫疾病管线,包含1型糖尿病、乳糜泻和狼疮。
4.辉瑞430亿美元并购ADC公司Seagen。辉瑞宣布将以总价值约430亿美元收购专注于肿瘤领域的抗体偶联药物(ADC)公司Seagen。Seagen公司目前共有4款新药获FDA批准上市,其中靶向CD30的ADC药物维布妥昔单抗(Adcetris)已在2011年8月获FDA批准用于霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤,2022年11月该新药用于霍奇金淋巴瘤适应症获批扩展至2岁及以上儿科患者。此次收购,辉瑞将拟定组合增强其在肿瘤领域的领导地位。
5.指环病毒载体基因药物公司完成C轮融资。致力于利用指环病毒作为载体的基因药物开发公司Ring Therapeutics宣布完成8650万美元的C轮融资。与腺相关病毒(AAV)载体相比,指环病毒载体能够定向到人体特定的部位且无免疫原性,消除AAV的两种(组织特异性和免疫原性)限制;而且指环病毒载体基因治疗药物有望实现多次给药。此轮融资将进一步将Ring Therapeutics开发的Anellogy™ 平台推向临床阶段。
6.Mersana公司HER2-ADC暂停临床。Mersana公司与葛兰素史克合作开发的HER2-ADC药物XMT-2056的I期试验被FDA暂停。原因是该项试验出现与XMT-2056治疗相关的5级致命不良事件(SAE)。SAE发生在第2例患者身上,该患者是HER2+、复发性或转移性实体肿瘤经治患者,在Ⅰ期试验的剂量递增部分以初始剂量水平入组。此前,FDA已授予XMT-2056治疗胃癌的孤儿药资格。
医药热点
1.CDE连续发布4项指导原则。近日,CDE连续发布4项指导原则,分别为:《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》;《晚期前列腺癌临床试验终点技术指导原则》;《脂质体药物质量控制研究技术指导原则》(征求意见稿);《脂质体药物非临床药代动力学研究技术指导原则》(征求意见稿)。前两项《指导原则》自发布之日起施行,后两项征求意见稿时限为自发布之日起1个月。
2.符合要求的“互联网+”医疗服务可纳入医保支付。针对“将互联网远程会诊远程诊断费用纳入医保结算体系”的建议,国家医保局近日答复,对于定点医疗机构提供的“互联网+”医疗服务,与医保支付范围内的线下医疗服务内容相同,且执行相应公立医疗机构收费价格的,经相应备案程序后,纳入医保支付范围,并按规定支付。
3.校园不强制要求师生佩戴口罩。3月13日,教育部、国家卫生健康委、国家疾病预防控制局联合发布《关于印发高等学校、中小学校和托幼机构新型冠状病毒感染防控技术方案(第七版)的通知》,明确高校、中小学不强制要求师生佩戴口罩;幼托机构幼儿在园期间不佩戴口罩,教职员工在园期间不强制要求佩戴口罩。
评审动态
1. CDE新药受理情况(03月14日)
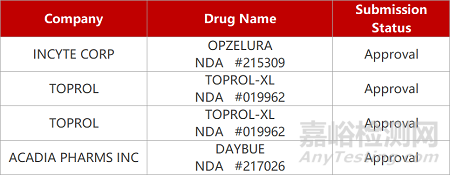
2. FDA新药获批情况(北美03月10日)