1、抗体偶联药物(ADC, antibody-drug conjugate)的定义
抗体偶联药物(ADC)由抗体、细胞毒素和连接子组成(如图1[1]),被认为是一种靶向治疗各种类型肿瘤和癌症的创新治疗方法,能够提高细胞毒素的治疗参数,降低全身细胞毒性的可能性。ADC依靠高度靶向的肿瘤抗原识别和有效的内吞,在细胞表面识别并结合特定的肿瘤抗原,然后通过内吞作用进入肿瘤细胞,连接子或抗体在核内体或溶酶体内被消解,从而释放细胞毒素杀伤肿瘤细胞[2],同时,能够起到延长细胞毒素的半衰期和降低其剂量限制性毒性的作用[3-5]。
图1 ADC结构示意图[1]
2、ADC的一般生物分析策略
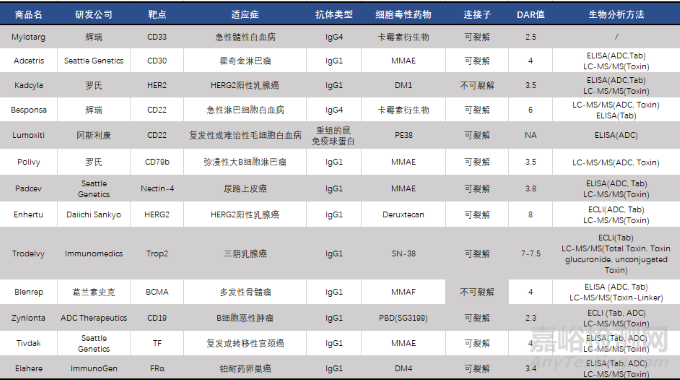
ADC药物的生物分析数据对于临床前以及临床研究的药物代谢,毒性评价的起着重要的作用。由于ADC药物结构的复杂性以及DAR值随着药物代谢不断变化,通常需要对其几种主要的存在形式进行定量分析,包括总抗体(DAR≥0)、偶联抗体(DAR≥1)和非偶联药物[6-10]。基于配体结合分析(LBA,Ligand binding assay)和液相色谱-串联质谱检测(LC-MS/MS, Liquid chromatography-tandem mass spectrometry)的生物分析方法已被用于分析各种ADC分析物[9,11]。其中LBA的分析方法通常用于检测总抗体、偶联抗体,LC-MS/MS的分析方法主要用于抗体结合的细胞毒素和非结合细胞毒素的分析,FDA已批准上市的药物相关生物分析策略如表2所示。
表2 FDA批准上市的ADC药物汇总
备注:ELISA: Enzyme-Linked Immunosorbnent Assay, 酶联免疫吸附法; ECLI: Electrochemiluminescence, 电化学发光法; LC-MS/MS: Liquid chromatography-tandem mass spectrometer, 液相色谱-串联质谱;
ADC: 抗体偶联物Tab: Total Antibody, 总抗体;Toxin: 细胞毒素;
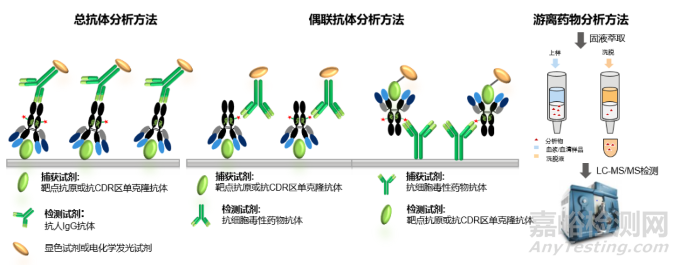
对于总抗体和偶联抗体的测定,最为广泛使用的是ELISA(Enzyme-Linked Immunosorbnent Assay, 酶联免疫吸附法)和ECL(Electrochemiluminescence immunoassay , 电化学发光免疫测定),如图2所示,对于总抗体的检测,通常包被靶点抗原或抗CDR区(ADC抗体的互补决定区)单克隆抗体方式进行捕获,通过抗ADC药物的抗体部分进行检测。对于偶联抗体的检测则有两种方式,一种采用的与总抗体检测相同的捕获试剂,检测试剂则采用的是抗细胞毒素的抗体;另一种采用的捕获试剂为抗细胞毒性药物的抗体,检测试剂则是靶点抗原或抗CDR区单克隆抗体。游离细胞毒素的检测是通过蛋白沉淀,液液萃取或固相萃取等小分子生物分析常用的前处理方法提取细胞毒素后直接进行LC-MS/MS的检测。
图2: ADC生物分析的常用策略
但当面临特异性试剂制备周期过长或者试剂的特异性、亲和力不满足测试需求时,LC-MS/MS平台则能够提供一个速度快、成本低、一份样品分析ADC全部检测组分的优质解决方案。
3、LC-MS/MS:一份样品完成ADC药物的全组分分析
随着LC-MS/MS方法检测抗体等蛋白物质的技术逐渐成熟,也因其具有良好特异性,在ADC药物的生物分析中除了将其应用于游离小分子细胞毒素和偶联在抗体上的小分子细胞毒素的定量分析,还能在合适的免疫捕获及酶解处理后,通过特征肽段对抗体部分进行定量分析。这就意味着,我们可以使用同一份样品在LS-MS/MS平台同时进行总抗体,偶联抗体,以及偶联药物和非偶联药物的检测。具体流程如图3所示,一份样品经过免疫捕获之后,得到上清直接用于游离细胞毒素的检测,捕获下来的抗体部分,分成两部分,分别进行处理,检测偶联抗体和总抗体。
图3 ADC的LC-MS/MS平台分析流
3.1 游离细胞毒素的药物分析
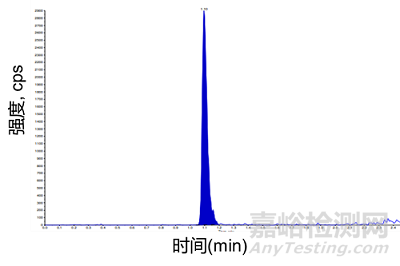
游离细胞毒素的药物分析有两大注意事项,分别为灵敏度和稳定性。由于ADC的靶向性,以及临床前安评试验都用健康动物,缺少释放毒素的肿瘤微环境,使得血浆中游离的毒素浓度极低,因此,定量下限需要做到皮克级。图4为含10pg/mL MMAE大鼠血浆样品的LC-MS/MS色谱图。此外,由于最常用的蛋白沉淀方法处理样本如果不够干净,可能会对检测带来干扰,可以通过液液萃取或是固相萃取的方法,使样本前处理更加干净,还能够浓缩样本,提高灵敏度。
为了得到样本中真实的游离毒素浓度,连接抗体和毒素的连接子的血浆稳定性也需要考察。在稳定性考察实验中,不仅要考察毒素本身在生物基质中的稳定性,还需考察ADC在样品储存过程中以及处理过程中是否释放游离毒素。
图4. 含10pg/mL MMAE的大鼠血浆样品的LC-MS/MS色谱图
3.2 偶联抗体分析
分析偶联抗体,需要针对不同的连接子选择不同的解离条件。如果是采用酶来断开毒素,酶的种类选择,酶切的条件需进行细致的打磨,以得到尽可能高的酶切回收率。如图5所示,通过这种方式,标准曲线可以在100倍左右的浓度范围内呈现良好的线性回归。对于可裂解的连接子,我们可以选用对应的酶,将其断裂,然后直接测毒素的浓度即可。对于不可裂解的连接子,我们可以选择Trypsin将其酶切,然后测毒素-连接子连接抗体的部分。
图5.大鼠血浆中ADC药物的标准曲线
3.3 总抗体药物分析
和偶联抗体相似,总抗体的测定需要经过捕获、酶切等步骤,其中每一步在试剂选择、反应时间、用量等方面都需要进行细致的探索,以达到理想的回收率。
3.4 DAR值测定
随着ADC药物在体内代谢,抗体上小分子药物的载量会逐渐减少,对应着DAR的变化,而DAR的变化趋势可以辅助阐释ADC安全性和有效性。一个理想的ADC药物应该是在血液循环中不释放细胞毒素,到了靶向器官,再释放,起到减小生物毒性,增加药效的作用。由于不同DAR的ADC的绝对分子质量不同,高分辨率质谱四极杆-飞行时间分析器(HRMS-Q-TOF, High resolution mass spectrometry quadrupole - Time of Flight analyzer)因其高的分辨率,特异性和准确性的特性,在DAR的分析方面较普通质谱例如三重四极杆更有优势,但其在灵敏度方面的表现乏善可陈,其定量下限往往只能做到ug/mL级别。
DAR值测定分为几种情况,可直接检测完整ADC分子的DAR,这种情况需要经过免疫捕获,然后经过去糖基化等步骤,再进入高分辨质谱进行完整分子的测定,这样可以直接反映出ADC分子上连接毒素的情况。而对于一些毒素只连接在轻链或者重链上,且连接情况比较简单的情况下,也可以考虑用特定的试剂还原或者酶解,,然后测ADC的亚单位,这样做的优势是可以提高灵敏度。这部分的方案需根据具体的案例来特殊定制。
4、ADC抗体部分检测的分析平台对比
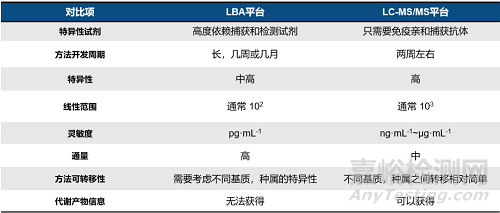
综合来说, LBA和LC-MS/MS分析ADC药物的总抗体和偶联抗体,在特异性试剂的需求,特异性,灵敏度,通量等方面各有优势。如表2所示,LBA平台高度依赖于特异性试剂的质量和制备,那么其制备的质量和时间也影响着方法的特异性和开发周期,但是它的优势在于灵敏度好,可以达到皮克级水平。
LC-MS/MS平台分析抗体是通过特征肽段来进行分析的,不依赖于特异性试剂,因此方法开发的周期较LBA平台更短,成本更低。这一优势在不断涌现的双抗ADC药物的生物分析中更加突出。同时,一份样品可以进行ADC多种形态的测定,定量下限可以做到10ng/mL,能够很好的满足一般检测需求。因此,可以根据检测需求选择分析平台。当特异性试剂的制备周期过长,或特异性试剂的特异性不理想时,选择LC-MS/MS平台进行ADC药物的检测可以实现6周快速完成方法的开发和验证以及样品分析,同时因为不需要制备高成本的特异性试剂,方法和分析的费用也会有所降低。加上LC-MS/MS平台可以做到同一份样品得到所有组分的浓度结果这一独特优势,数据也具有更好的可比性。
当然,随着质谱技术的不断发展,LC-MS/MS分析的灵敏度在未来还会有更多的进步空间,来满足更多的应用场景。
表2 LBA和LC-MS/MS平台分析抗体组分的对比
参考文献:
[1] 抗体偶联药物在胃癌治疗中的研究与思考. 肖礼海, 夏钢, 王坚成等, 生物医学转化[J] 2022,3(1).
[2] Lu J; Jiang, F; Lu, A.; Zhang, G. Linkers Having a Crucial Role in Antibody–Drug Conjugates. Int. J. Mol. Sci. 2016, 17(4), 561.
[3]. Chari, R.V.J. Targeted cancer therapy: Conferring specificity to cytotoxic drugs. Acc. Chem. Res. 2008, 41, 98–107.
[4] Senter, P.D. Potent antibody drug conjugates for cancer therapy. Curr. Opin. Chem. Biol. 2009, 13, 235–244.
[5] Senter, P.D. Potent antibody drug conjugates for cancer therapy. Curr. Opin. Chem. Biol. 2009, 13, 235–244.
[6] Stephan JP, Chan P, Lee C et al. Anti-CD22-MCC-DM1 and MC-MMAF conjugates: impact of assay format on pharmacokinetic parameters determination. Bioconjug. Chem. 19(8), 1673–1683 (2008)
[7] Buckwalter M, Dowell JA, Korth-Bradley J et al. Pharmacokinetics of gemtuzumab ozogamicin as a signal-agent treatment of pediatric patients with refractory or released acute myeloid leukemia. J. Clin. Pharmacol. 44(8), 873-880(2004)
[8] Hussain A, Gorovits B, Leal M et al. Pharmacokinetics of immunoconjugate anti-cancer agent CMD-193 in rats: ligand binding assay based approach to determine in vivo immunoconjugate stability. Bioanalysis 6(1), 21-32(2013)
[9] Kaur S, Xu K, Saad Om, Dere RC et al. Bioanalytical assay strategies for the development of antibody drug conjugate biotherapeutics. Bioanalysis 5(2), 201–226 (2013)
[10] Alley SC, Benjamin DR, Jeffrey SC et al. Contribution of linker stability to the activities of anticancer immunoconjugate Bioconjug. Chem. 19(3), 759-765(2008).
[11] Gorovits B, Alley S, Bilic S et al. Bioanalysis of antibody–drug conjugates. AAPS ADC working group position paper. Bioanalysis 5(9), 997–1006 (2013).