您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-06 11:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.康宁杰瑞拟公布2款双抗最新临床数据。康宁杰瑞发布公告,宣布将在ESMO2022年会上以壁报形式公布PD-L1/CTLA-4双抗KN046和HER2双抗KN026的四项临床研究积极数据。分别为:KN026联合KN046用于治疗既往未接受系统性治疗的HER2阳性局部晚期不可切除或转移性胃/胃食管结合部癌(GC/GEJ)的Ⅱ期临床研究数据;KN046联合含铂双药化疗一线治疗非小细胞肺癌(NSCLC)的两年随访数据;KN046用于一线含铂双药化疗治疗失败的转移性NSCLC患者的Ⅱ期研究数据;KN046用于既往EGFR-TKIs治疗失败的转移性NSCLC患者的Ⅱ期研究数据。
2.沃森/蓝鹊新冠mRNA疫苗获批临床。上海蓝鹊生物联合复旦大学和沃森生物开发的新冠mRNA疫苗(S蛋白嵌合体)RQ3013获国家药监局临床许可。RQ3013是一款针对新冠病毒变异株开发的、编码全长S蛋白嵌合体的创新型广谱新冠mRNA疫苗,具有自主知识产权。该疫苗对包括Omicron在内等新冠VOCs变异株均具有交叉中和能力。今年5月,RQ3013已在Clinicaltrials.gov网站上登记启动一项Ⅰ期临床。
3.泽璟杰克替尼获FDA批准斑秃临床。泽璟制药自主研发的新型JAK抑制剂盐酸杰克替尼片获FDA批准第二项临床许可,拟开发用于治疗重症斑秃。此前杰克替尼已在美国启动I期临床,FDA已授予其用于治疗骨髓纤维化的孤儿药资格。目前,盐酸杰克替尼还在多项临床研究中评估治疗潜力,适应症包括中重度特应性皮炎、强直性脊椎炎、特发性肺纤维化、移植物抗宿主病及中重度斑块状银屑病等。
4.杨森口服IL-23受体拮抗剂在华获批临床。强生旗下杨森申报的JNJ-77242113-AAC(PN-235)获国家药监局临床默示许可,拟开发适应症为银屑病。PN-235是Protagonist公司开发的一款口服IL-23受体拮抗剂,强生目前拥有该新药的全球独家授权。根据ClinicalTrials官网,杨森正在就JNJ-77242113开展3项Ⅱ期临床研究,评估该药治疗中重度斑块状银屑病的安全性和有效性。
5.东北制药引进一款单抗全球权益。东北制药与MedAbome公司就后者一款抗肿瘤单克隆抗体MAb11-22.1签署项目转让、合作开发及技术服务协议。根据协议,MedAbome向东北制药转让MAb11-22.1,并基于该抗体双方进行ADC药物和CAR-T产品的合作开发;MedAbome负责申报美国、加拿大、墨西哥三个国家的临床开发和新药注册;东北制药将拥有MAb11-22.1及基于该抗体的药物在这三个国家以外的全球权益,拥有自行拓展合作产品在白血病和其他适应症的权利。东北制药将向MedAbome支付首付款、里程碑付款、销售提成等。
国际药讯
1.甲状旁腺功能减退症激素替代疗法报NDA。Ascendis公司长效激素疗法TransCon PTH已向FDA递交新药申请,用于治疗甲状旁腺功能减退的成人患者。在一项国际III期PaTHway试验中,与对照组相比,TransCon PTH治疗组实现不依赖常规治疗并保持血清钙水平在正常范围内(8.3–10.6 mg/dL)的患者比例更高(78.7%vs4.8%,p<0.0001);而且药物的总体耐受良好。如果获批,TransCon PTH将成为首款用于这类患者的激素替代疗法。
2.首款OTC用ED新药III期临床成功。Futura Medical公司基于其专有的DermaSys技术开发的一款硝酸甘油透皮凝胶制剂MED3000,在治疗勃起功能障碍(ED)的III期临床试验(FM71)达到主要终点。MED3000可在10分钟起效,并在治疗24周时,显著改善患者的勃起功能(p<0.001),其IIEF-EF评分平均提高5.73个单位。此外,MED3000总体耐受性良好,无严重不良事件发生。该公司计划向FDA提交上市申请,如果获批,MED3000有望成为首个用于治疗ED的非处方药(OTC)。
3.DMD创新疗法Ⅱb期临床积极。Santhera公司与ReveraGen BioPharma公司开发的“first-in-class”类固醇药物vamorolone在治疗杜氏肌营养不良症(DMD)的Ⅱb期临床VISION-DMD积极结果发表在JAMA Neurology期刊。与安慰剂组相比,vamorolone显著提高患者从仰卧姿态站起来的速度;与强的松相比,vamorolone的疗效达到非劣效标准;没有发现vamorolone在骨骼健康生物标志与线性生长上有负面的影响。两家公司预计今年内完成向EMA与FDA提交vamorolone的监管申请。
4.致命神经退行性疾病基因疗法早期临床积极。Forge Biologics公司新型基因疗法FBX-101治疗Krabbe病患者的Ⅰ/Ⅱ期临床RESKUE结果积极。FBX-101旨在向中枢和外周神经系统中的细胞递送GALC基因的功能拷贝。该项研究结果显示,受试者在清髓和脐带血干细胞移植术后接受FBX-101治疗180天期间,该疗法的安全性和耐受性均良好;患者的白细胞中半乳糖甘油糖苷酶(GALC)活性显著增加,患者的运动功能得到改善,大脑发育正常。
5.全球首款工程化B细胞疗法获批临床。Immusoft公司基于其专有的免疫系统编程技术平台开发的B细胞候选疗法ISP-001获FDA临床许可,拟用于黏多糖贮积症I型患者的治疗。根据2021年10月与武田达成的战略合作协议,Immusoft将获得该项目的研发里程碑付款。ISP-001也是全球首款进入临床阶段的工程化B细胞疗法,FDA此前已授予其孤儿药资格。
医药热点
1.皮肤罕见病专科医联体成立。皮肤罕见病医联体8月27日正式成立,该联盟由中国罕见病联盟皮肤罕见病专业委员会及北京协和医院牵头成立,共有107家成员单位,涵盖全国26个省、自治区、直辖市。皮肤罕见病医联体的成立,旨在实现基层首诊、上下联动、双向转诊的分级诊疗模式,缓解皮肤罕见病诊治水平区域不平衡现状。
2.上海市公卫临床中心应急医学中心项目获批。上海市公卫临床中心应急医学中心项目日前获上海市发改委可行性研究报告批复。项目选址位于上海市公共卫生临床中心院区内(金山区漕廊公路2901号),新建总建筑面积152777平方米(其中地上106542平方米),拟新建医疗综合楼、多功能综合楼、能源中心及液氧站等。整体建筑设计响应“平疫结合”的总体设计原则,以打造“感染性疾病综合诊疗和应对突发公共卫生疫情”为特色的国际一流的公共卫生临床中心。
3.军团菌为阿根廷“不明原因肺炎”致病原因。当地时间9月3日,阿根廷参议院健康委员会主席、前图库曼省公共卫生局局长巴勃罗·耶德林在接受媒体采访时表示,根据实验室数据,近日在图库曼省鲁兹医院发现的不明原因肺炎的致病原因是军团菌。截至目前,该肺炎在阿根廷北部的累计确诊病例数为11例,累计死亡5例。
评审动态
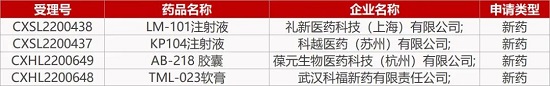
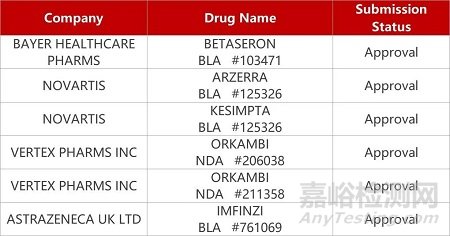

来源:药研发


