您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-22 19:44
对照品(标准品)是执行药品质量标准的实物对照,是量值传递的重要载体,是用来检查药品质量的一种特殊的专用量具、测量药品质量的基准、确定药品真伪优劣的物质对照,也是作为校正测试仪器与方法的物质标准。对国家药品标准而言,它是国家颁发的一种药品计量、定性的标准物质。药品标准物质必须具备材料均匀、性能稳定、量值准确等条件,才能发挥其统一量值的作用。
在药物研发当中,对照品(标准品)涉及量值溯源、产品定性、杂质控制等重要环节,其制备和标定情况与药品的质量研究、稳定性研究乃至药理毒理学研究中剂量的确定等临床前基础研究间存在密切关系,因此,药品对照品(标准品)的制备与标定是药品技术审评的一项重要内容。一般来讲,药品研发中标准物质的使用一般可参照如下原则:
一、杂质对照品的含量要求
在新药研制中,有些含量测定方法采用了药典收载的鉴别用对照品,应该按含量测定用对照品要求作纯度与含量考察,如符合要求可以采用,如纯度差应经精制后选用,如在检验方法研究中只要杂质峰不干扰测定可以暂用,但如制定标准限度,必须确切了解对照品的纯度与含量。
含量测定缺乏专属性关于含量测定,并非每个药品都需用专属性好的方法,由于化学原料药大多数是单一的较纯物质,并在检查项下已对其主要杂质进行控制,因此健全而的方法较专属但性较差的方法为好,欧洲药典也认为如果鉴别和纯度实验已能充分反映被测物质的特性和品质,那么分析方法的性就成为选择含量测定方法的主要依据,因而UV法常被国内外药典应用。
但有的药品含量测定,却必须注意方法的选择性,特别是许多性质不稳定的抗生素含量测定。例如中国药典1995年版头孢拉定采用HPLC法,这是由于头孢拉定的环己二烯基团在氧气和水分的作用下易氧化为苯基而成为头孢氨苄,微量金属如铁也能加速这种反应,所以头孢拉定中不可避免地存在有头孢氨苄,且其含量不可忽视。药典中头孢拉定原料中头孢氨苄控制在0%以下,制剂控制在0%以下就是这个道理。
但有文献却采用UV法监测头孢拉定半成品的含量,由于UV法选择性差,测定的只能是头孢氨苄和头孢拉定及其它相关物质的总和,头孢氨苄的大吸收波长为,吸收系数为220~245,头孢拉定大吸收波长为,吸收系数为215~240,两者基本相同,当头孢拉定降解而含量不合格时,UV法不能反映头孢拉定中头孢氨苄的变化。
中国药典中对头孢拉定及其中所含头孢氨苄均有限度要求,而UV法既不能准确反映头孢拉定的含量,又不能反映头孢氨苄的含量,因此UV法监测头孢拉定制剂含量是不可行的,可能会使不合格的产品得不到控制而造成重大损失,这也是我们在实际检验中遇到的问题:头孢拉定原料中头孢氨苄含量一般较低,约2%,但由于贮藏或生产工艺不当,其制剂中出现头孢拉定含量低于药典限度或头孢氨苄含量超过药典限度的情况。部标准中肌苷制剂的含量测定也存在同样的问题。
二、杂质对照品标准品合规性要求
1、所用对照品(标准品)中检院已有发放提供,且使用方法相同时,应使用中检院提供的现行批号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源的标准物质;使用方法与说明书使用方法不同时,如定性对照品用作定量用、效价测定用标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等,应采用适当并经验证的方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。
2. 中检院尚无对照品(标准品)供应时,可使用如下标准物质进行标准制订和其他前期基础性研究工作:
(1)国外药品管理当局或药典委员会发放的对照品(标准品)或国外制药企业的工作对照品(标准品),但应提供其包装标签的彩色照片及使用说明的复印件,说明批号、有效期、使用方法等信息,能保证其量值溯源性;
(2)申请人自行标定或委托省所完成对照品(标准品)的标定,申报时提供标准物质的研究资料及相关信息,一般包括如下内容:
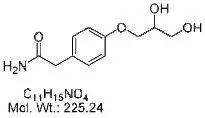
①主成分对照品--制备工艺、结构及含量方面的研究资料以及通用名、化学名、结构式、分子式、分子量、各种杂质含量(水分、残留溶剂、无机盐等)、主成分含量测定数据(不同分析技术)、用途、贮藏条件等信息。
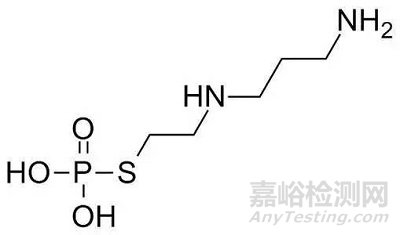
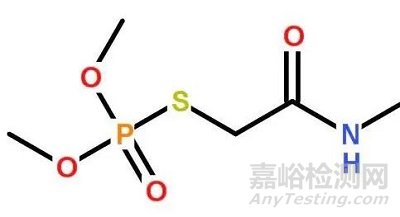
②杂质对照品--制备工艺、结构(UV,IR,NMR,MS,X射线衍射的解析或提供对照图谱)及含量(不同分析技术)方面的研究资料以及化学名称、结构式、分子式、分子量、用途、贮藏条件等信息。
③混合对照品(定位)--各组分制备工艺、结构(UV,IR,NMR,MS,X射线衍射的解析或提供对照图谱)及纯度方面的研究资料以及化学名称、结构式、分子式、分子量、含量(如必要)、定性具体方法与限度要求。
同时,申请人应及时与中检院接洽对照品(标准品)的标定事宜,以便产品上市后可以及时获得法定标准物质。
3、质量标准中用到的对照品如中检院在目前情况下尚不能正常提供,建议申请人在申报资料中明确产品上市后,标准物质的可获得性及相应措施。
4、质量标准中涉及到的各已知杂质,应在质量标准中明确其通用名称(或化学名称)、化学结构式、分子式、分子量等相关信息,以准确指称、控制各特定已知杂质。
5、一般情况下,为确保标准物质的准确使用和控制,尚需提供对照品(标准品)的质量标准,并规定专属性控制项目,如非对映异构体杂质的比旋度等。

来源:北京药研汇


