您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-07-29 14:57
摘要
根据美国药典<1224>和中国药典2020版9100方法转移指导原则,可以认为分析方法的转移是一个有据可查的过程,使分析方法接收方有资格使用先前由转移方按预期开发的分析方法。本文是笔者对老生常谈的分析方法转移问题的再论述,不足之处还望指正。
分析方法转移是一个试验确认和文件记录的过程,目的是证明一个实验室在采用另一个实验室建立并经过验证的非法定分析方法或采用的法定分析方法检测样品时,该实验室用能力成功地操作该方法,检测结果一致。分析方法转移是保证检测结果质量,保证不同实验室之间得到一致、可靠和准确检验结果的一个重要环节,同时也是对实验室检验能力的一个重要评估。
分析方法转移主体
分析方法转移的主体是转移方和接收方,转移方一般是一个实验室,被转移方法在该实验室进行开发、验证和或应用。接收方一般也是一个实验室,该实验室一般是与生产息息相关或与生产有合同约束的实验室。
分析方法转移范围
公司内部不同位置之间转移;
分析方法研发实验室和质量控制实验室之间转移;
合同约定的不同公司之间转移;
进口药品质量标准复核
分析方法转移主体责任
在分析方法转接双方签订好协议后;需要成立分析方法转移团队,约定双方的责任。分析方法转移过程中双方责任见表1。
分析方法转移关键因素
方法转移成功的关键因素在于分析方法接收方和转移方之间能够诚实互信的沟通以及在分析方法转移开始前详细的风险分析。此外,应该给分析方法转移留出足够的时间,因为接收方需要购买和计量设备,并且在使用分析方法进行检测前必须已经完成了该分析方法的转移。表2是分析方法转移关键因素。

分析方法转移中文档转移
转移方需要向接收方提供最新版的文档。并且文档至少应该详细的方法及其验证,最好提供方法开发报告、验证过程中出现的偏差,验证结果的计算方法及可接受标准,详细的溶液稳定性研究结果等。
分析方法转移策略
基于对每种分析方法的风险评估,需要选择合适的转移策略。美国药典、中国药典、ISPE中均提到分析方法转移策略,但都没有对分析方法转移中的实验设计、可接受标准等关键信息进行规定。表3是基于美国药典<1224>中对转移策略的理解性描述。

分析方法转移中重现性试验及培训
在进行分析方法转移前,接收方应该进行重现性试验,如果有必要的话,转移方应该对接收方进行必要的培训。接收方应该充分了解被转移方法所用设备、试剂等信息,并且应该充分了解样品的处理和制备。
接收方在确保重现性试验没有问题的前提下,可按照转移计划进行方法转移实验。
分析方法转移中样品转移
为特定分析方法定义最佳样品是非常重要的,样品转移主要包括:
分析方法转移计划
欧洲GMP指导原则(第六章)、美国药典<1224>、WHO指导原则及中国药典<9100>均详细描述了转移方案。通常包括以下内容:
一般来说转移计划是由分析方法转移方创建,因为他们对方法是非常熟悉的。转移计划只有在被批准后才是有效的,并且批准程序是转接双方同时参与的。转移计划批准后,分析方法接收方可以独立或者与转移方共同进行重现性试验来熟悉拟转移分析方法。当然也可在完成重现性试验后再制定转移计划。
分析方法转移可接受标准
可接受标准应该与被转移分析方法兼容,对于一些简单不重要的方法,可以将检测结果直接与限度进行比较,对于复杂或重要的方法,则需要进行统计学分析。直接比较的可接受标准是基于经验或被转移方法的要求。
如果转移实验不符合可接受标准,需要对偏差进行调差并且找到根本原因。只有采取了纠正预防措施后,才能重复进行转移实验,并将所有调查和处理行动记录在转移报告中。
分析方法转移实验
所有的转移试验必须严格按照转移计划执行,并且任何偏差都要被记录并进行评估。对于超限操作必须进行调查并记录,找到根本原因后整改后重新操作。除了“直接应用”和“与确认结果进行比较”两个转移策略外,转移实验过程中所获得结果不构成质量过程中定义的可报告结果,因此,超出放行验收标准的结果在形式上是没有OOS结果的,即使使用了上市批次。
表4 各检测项目可能的实验设计及相关可接受标准
分析方法转移报告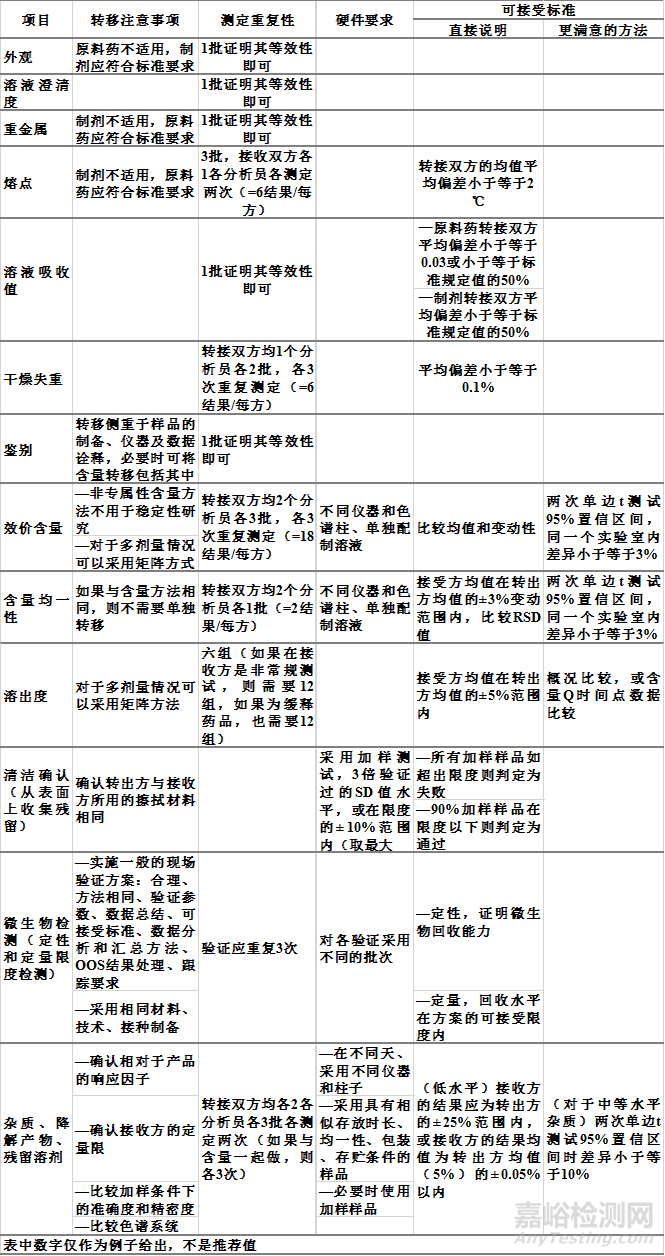
转移报告应该描述转移实验的操作过程、总结实验结果和相关参数的可接受标准。所有数据应该抄送至转移方审核。任何偏差的描述和评估应详细记录在转移报告中。转移报告应清晰的给出转移结论。一般来说转移报告至少应该包括:
7、转移谱图等附件
分析方法转移过程
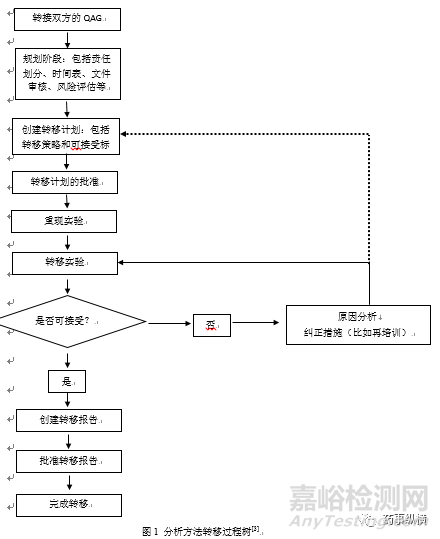
图1是分析方法转移过程树,基本囊括了分析方法转移的全过程。
结语
分析方法转移是保证方法接收方成功操作分析方法的一个重要步骤,也是评估方法接收方检验能力的一个重要指标。本文是作者查阅参考文献并结合自己理解对分析方法转移的再叙述。由于笔者知识有限,文中难免出现纰漏,还望各位同行多多指教,批评。
【4】EU GMP

来源:药事纵横


