您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2018-07-12 16:31
本次主动召回原因如下:产品的包装可能没有密封、受影响批次产品可能存在混放的问题、一些产品无菌包装的密封封口质量不符合规范、产品在被用于外科手术时极低可能存在缝线因过早失去抗张而导致手术后且伤口愈合之前发生缝线断裂的情况和产品某些包装批次的包装密封性可能存在破坏。具体情况如下:
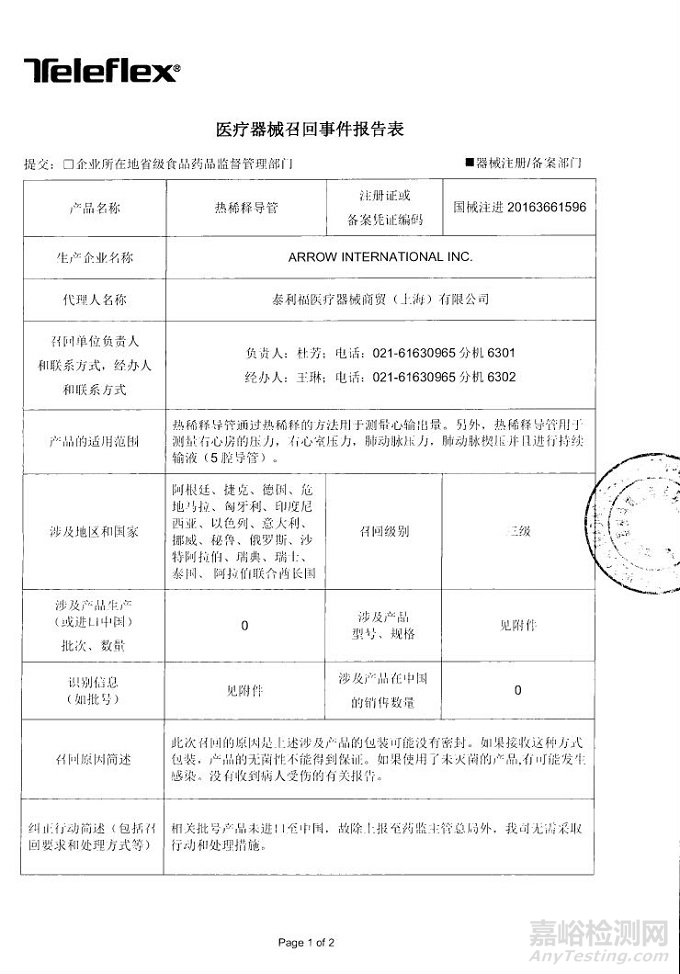
ARROW INTERNATIONAL INC.对热稀释导管主动召回
2018年07月11日 发布
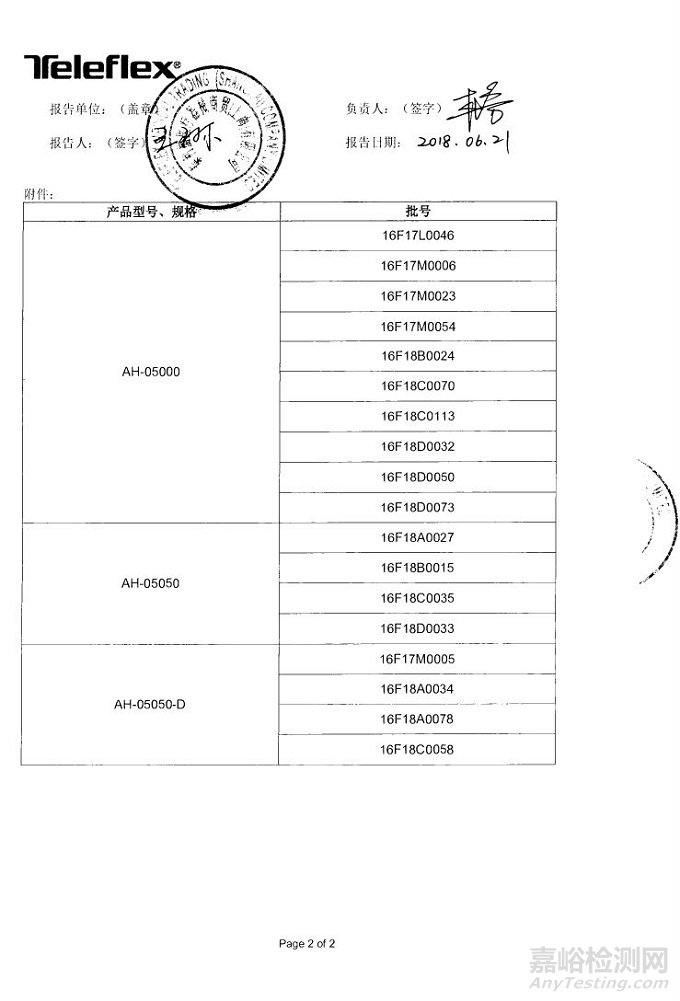
泰利福医疗器械商贸(上海)有限公司报告,由于产品的包装可能没有密封,生产商ARROW INTERNATIONAL INC.对热稀释导管(注册证编号:国械注进20163661596)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年7月9日
附件:
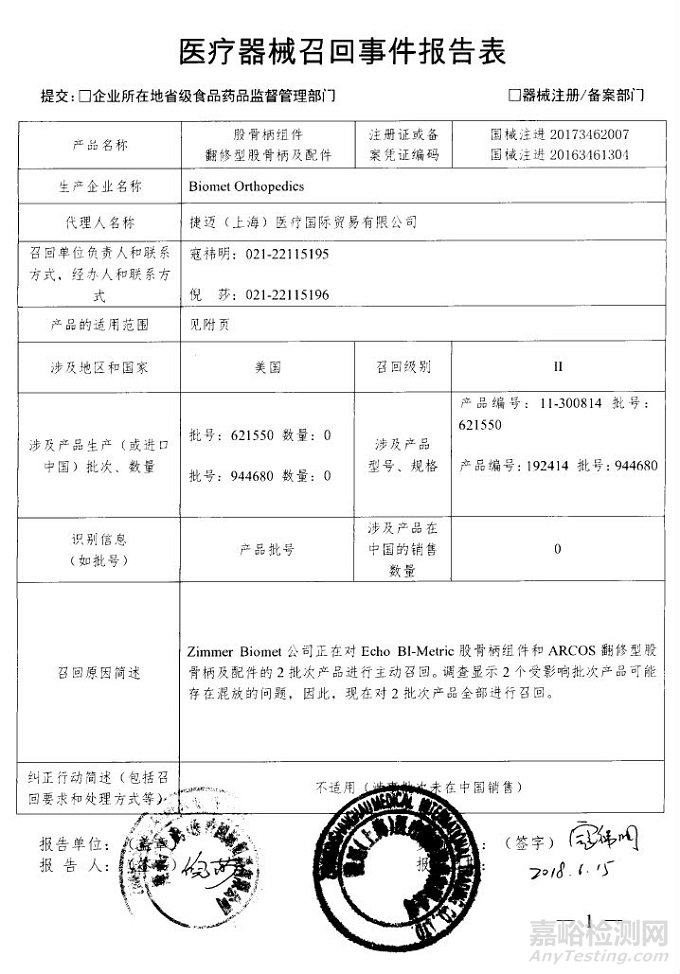
Biomet Orthopedics对股骨柄组件和翻修型股骨柄及配件主动召回
2018年07月11日 发布
捷迈(上海)医疗国际贸易有限公司报告,由于受影响批次产品可能存在混放的问题,生产商Biomet Orthopedics对股骨柄组件(注册证编号:国械注进20173462007)、翻修型股骨柄及配件(注册证编号:国械注进20163461304)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年7月9日
附件

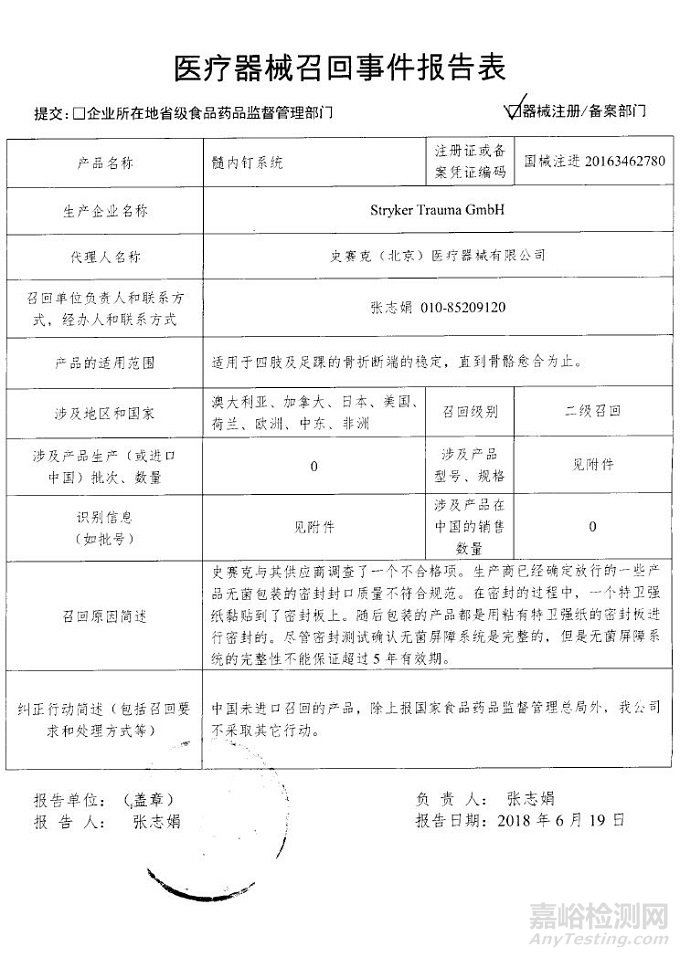
Stryker Trauma GmbH对髓内钉系统主动召回
2018年07月11日 发布
史赛克(北京)医疗器械有限公司报告,由于一些产品无菌包装的密封封口质量不符合规范,生产商Stryker Trauma GmbH对髓内钉系统(注册证编号:国械注进20163462780)主动召回。召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年7月9日
附件

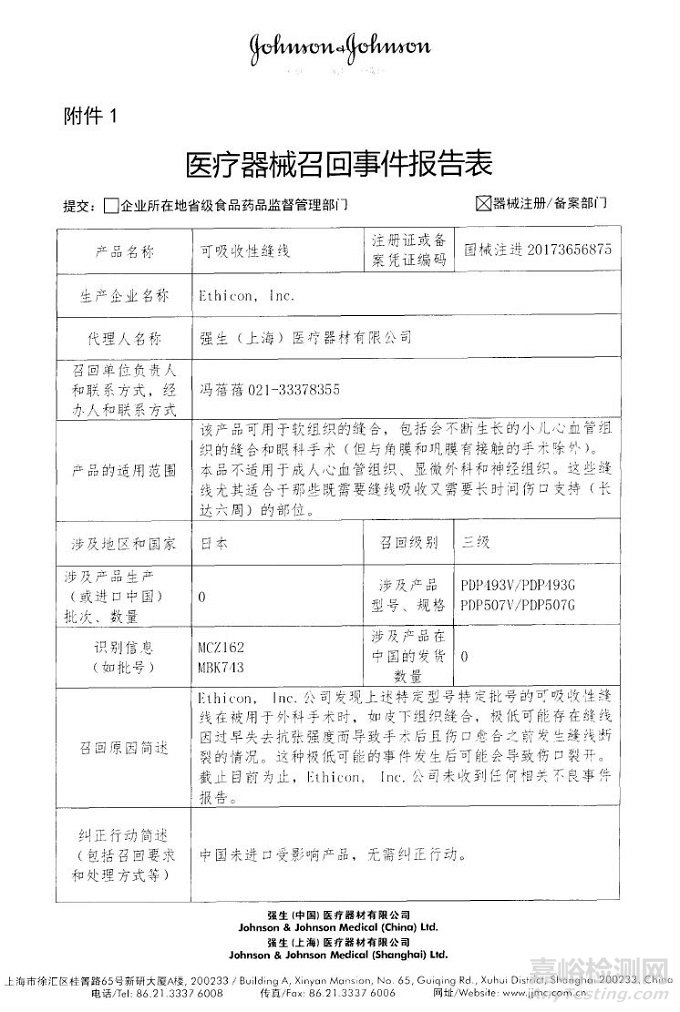
Ethicon, Inc.对可吸收性缝线主动召回
2018年07月11日 发布
强生(上海)医疗器材有限公司报告,由于产品在被用于外科手术时极低可能存在缝线因过早失去抗张而导致手术后且伤口愈合之前发生缝线断裂的情况,生产商Ethicon, Inc.对可吸收性缝线(注册证编号:国械注进20173656875)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年7月9日
附件

Ethicon LLC对合成可吸收性外科缝线主动召回
2018年07月11日 发布
强生(上海)医疗器材有限公司报告,由于产品在被用于外科手术时极低可能存在缝线因过早失去抗张而导致手术后且伤口愈合之前发生缝线断裂的情况,生产商Ethicon LLC对合成可吸收性外科缝线(注册证编号:国械注进20143655892)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
附件:医疗器械召回事件报告表
2018年7月9日
附件

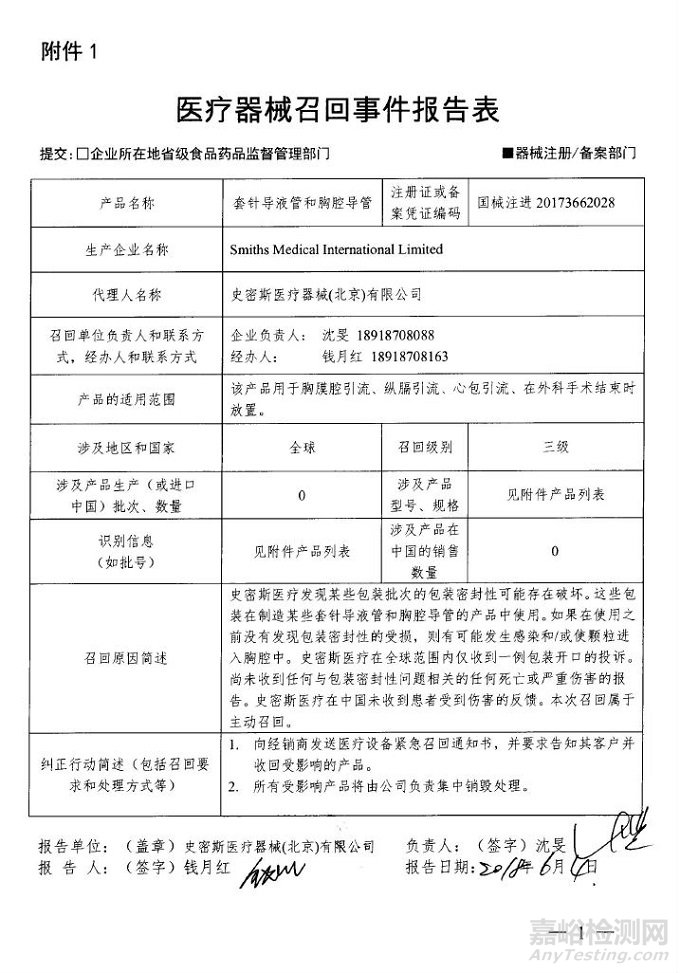
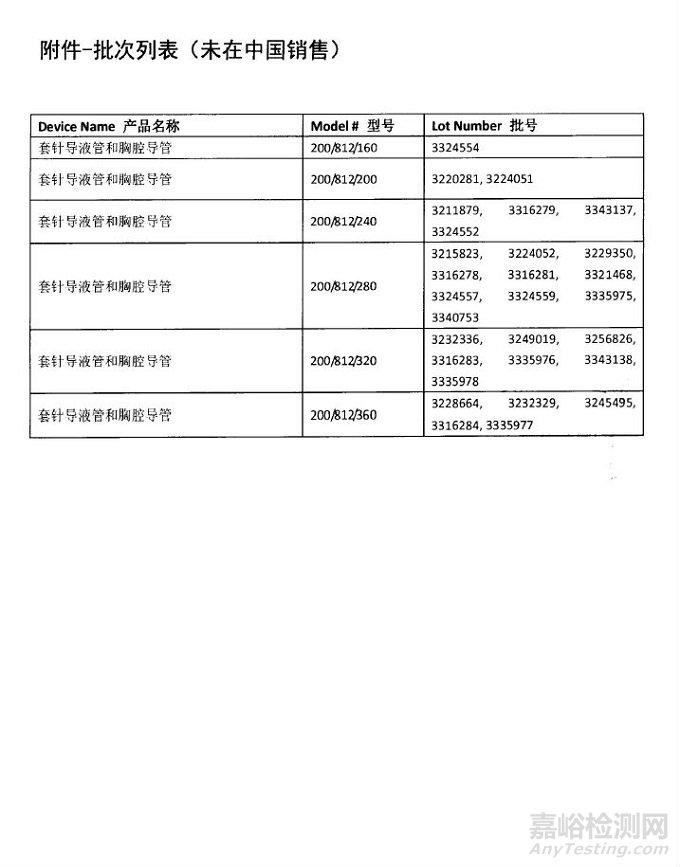
Smiths Medical International Limited对套针导液管和胸腔导管主动召回
2018年07月11日 发布
史密斯医疗器械(北京)有限公司报告,由于产品某些包装批次的包装密封性可能存在破坏,生产商Smiths Medical International Limited对套针导液管和胸腔导管(注册证编号:国械注进20173662028)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
2018年7月9日
附件

来源:国家药监局


