在MDR Article 54,用于给予/清除药品的 IIb 类有源器械(下文称ARMP器械)和III类植入器械被要求进行特定的临床评估咨询程序(CECP),这是MDR法规对欧洲医疗器械临床的新要求,对特定器械的额外审查。
CECP 确保公告机构准确评估III类植入器械和ARMP器械的临床数据的数量和质量,指定的专家小组会根据制造商的临床证据,就 NB 的临床评价评估报告 (CEAR) 提供独立的科学意见。
对于属于 CECP 范围内的每个器械,NB应向主管当局、负责NB的当局和欧盟委员会发送一份通知,并附上临床评价评估报告,说明 CECP 是否适用于相关器械;包含与未被 CECP 豁免的器械有关的文件的档案被转交给专家小组,但根据筛选小组的决定,并非所有 CECP 申请都一定会产生科学意见。
随之而来的MDR Article 54(4)中要求,欧盟委员会有义务起草一份关于适用 CECP 的器械的年度概览。
2023.1发布了首份年度概览,包括了2021.4-2022.6提交的通知,在此期间,只有8个公告机构根据Article 54(3)提交了215份通知,只有24起案件要求CECP,第二份年度概览涵盖了22.07-23.06专家小组的活动。
今年发布的年度概览在3月发布,较23年年度概览,信息更详实,值得广大III类植入器械和用于给予/清除药品的 IIb 类有源器械制造商参考学习。
几家NB提交CECP?提交了多少通知?豁免CECP数量及纳入CECP/专家小组发布意见数量是多少?
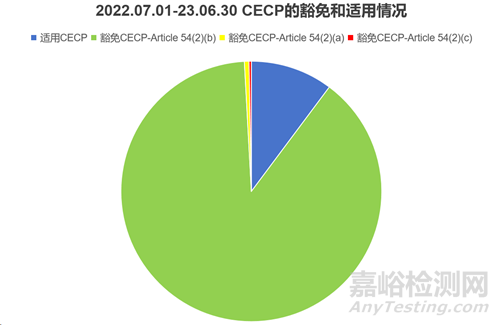
在22.07.01-23.06.30期间,NB根据Article 54(3) 发出了 353 份通知,适用CECP程序的有36台器械,317台器械根据Article 54(2)被豁免CECP,在被豁免 CECP 的器械中,314 台(99.1%)根据Article 54(2)(b)条获得豁免,2 台器械根据Article 54(2)(a)获得豁免,1 台器械声称适用Article 54(2)(c)。
在CECP程序适用的36台器械中,专家们筛选了 35 份 CECP 申请,决定对收到的 35 份 CECP 申请中的 4 份(12.0%)提出意见。2023 年 6 月 30 日,专家小组提出了所有 4 项意见。秘书处没有收到NB采纳专家小组意见的任何理由。
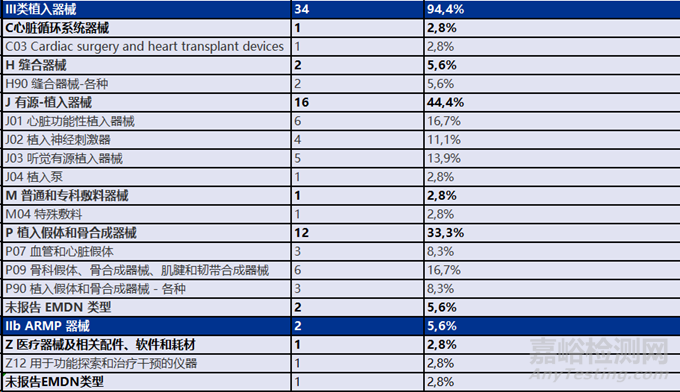
在36台适用CECP的器械中,34个是III类植入器械,2个是IIb ARMP器械,这些器械根据EMDN类型的描述如表所示:
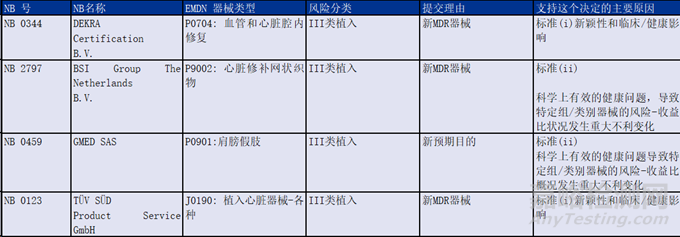
4个专家小组发布审核意见的产品具体情况如下:
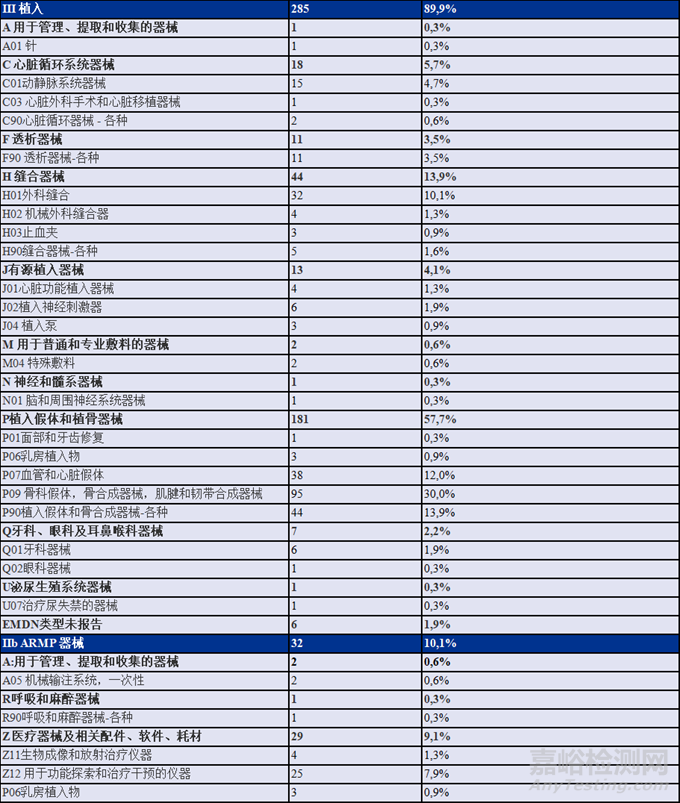
在获得 CECP 豁免的317台器械中,285个为III类植入器械,32个为IIb类ARMP器械。下表提供了根据EMDN类型对这些器械的描述。大多数获得CECP豁免的器械属于以下三大类:
•血管和心脏假体
•骨科假体,骨合成器械,肌腱和韧带合成器械(30.0%)
•植入假体和骨合成器械-各种
6例未明确EMDN类型
豁免的原因是,在99.1%的情况下(314个器械),对同一制造商已经销售的器械进行了修改,修改不会对风险-收益比产生不利影响(Article 54(2)(b)),在2个情况下,根据MDR (0.6%)(Article 54(2)(a)更新了证书,在1个情况下,NB声称豁免是由于通用规格可用(0.3%)(MDR Article 54(2)(c)),下表是具体情况: