在药品研发与生产过程中,工艺验证是一个极为重要的工作,也是一个极为重要的里程碑。然而即便如此重要,恐怕有些制药行业的同仁对它的了解还停留在“连续生产三批合格产品”、“工艺验证批量至少100万”、“工艺验证是个系统工程,需要写方案和报告”、“工艺验证产品需要进行稳定性”、“如果着急申报,可以先不进行工艺验证”等层面上吧。
实不相瞒,若不是经过这段时间的GMP学习,我对工艺验证的了解,也不比上面知道的多出多少。我之前也不知道工艺验证竟然是四种验证的统称,工艺验证需要贯穿产品整个生命周期,工艺验证的方案和报告竟有如此讲究,工艺验证还有这么多种方式进行,……
于是乎,本着“独乐乐不如众乐乐,独知知不如众知知”的意愿,将这段时间关于工艺验证的更多认知梳理成文,供各位同仁一起来深入了解“工艺验证”。
工艺验证属于“确认与验证”中“验证”的范畴,国内外相关指南对其的基本要求一致。具体指南如下:
|
机构或组织
|
文件名称
|
|
NMPA
|
GMP(2010版)、GMP附录:确认与验证
|
|
FDA
|
Guideline on general principles of process validation
工艺验证通用指南
|
|
EMA
|
Annex15 to the EU Guide to Good Manufacturing Practice, Qualification and Validation
欧盟GMP附录15 确认与验证
|
|
PIC/S
|
PI006-3 Validation master plan installation and operational qualification non-sterile process validation cleaning validation
验证总计划、安装确认和运行确认、无菌工艺验证、清洁验证
|
|
国际制药工程协会ISPE
|
Good practice guide: Practice implementation of the lifecycle approach to process validation
良好实践指南:工艺验证生命周期方法的实践
|
关于工艺验证的整体信息梳理如下:
1、定义
基于《GMP附录:确认与验证》中工艺验证的定义:为证明工艺在设定参数范围内能有效稳定地运行并生产出符合预定质量标准和质量特性药品的验证活动。
2、验证次数
听到验证次数,可能大家会默认为是连续三批工艺验证批次,其实这里所说的次数是工艺验证的次数,并非工艺验证所需的批次数。说到这里,可能有些小伙伴有点蒙圈,其实我想表达的意思是:在产品研发和生产的整个生命周期内,工艺验证要做多少次?
答案是,并非一次,而是很多次,贯穿整个产品生命周期的N多次。
对于只涉及药品研发的小伙伴们,可能难以理解,我研发申报阶段只需做一次就能申报了呀?
对于做生产质量的小伙伴们,如果对于工艺验证的四种类型不了够解,也容易对此心存疑虑,难道关于工艺验证还有我不知道的东西?
但当大家了解“工艺验证和验证状态”、“工艺验证包括首次验证、变更后验证、再验证和持续工艺确认四种类型”时,或许就能比较容易理解。虽然工艺验证是一个阶段性的活动,然而验证状态却是一个持续的状态。为了保证这种持续状态,需要进行持续工艺确认,以及定期或周期性的再验证。其中持续工艺确认、再验证是工艺验证的两种类型,同属工艺验证的范畴,因此可以说在产品生命周期整个过程,一次成功的工艺验证证实了工艺设计和控制策略的合理性,并证明了商业化生产工艺的性能符合预期,而无数次的持续工艺确认、再验证则保证了验证状态持续受控和有效。
3、验证批次
“企业通常应当至少进行连续三批成功的工艺验证。”这句话没有错,也是日常工作中默认连续三批作为工艺验证批的依据,但要注意这句话的一些关键限定词:
1)“通常”:一般情况,特殊情况不适用,比如一些孤儿药,一年还不一定能生产3批呢,如何找连续生产三批呢。
2)“至少”:三批是最低限,也有可能会多于三批,具体批次应由风险评估而定。
3)“连续三批成功的”:不是凑够三批就行了,而是要凑够连续三批。例如:如果第1批成功,第2批失败,第3、4批成功,那1、3、4合在一起是凑够三个批次了,但这三个批次不能作为工艺验证批的批次,还需进行第5批。如果第5批成功了,则3、4、5三批为连续成功的三批,可作为工艺验证的批次,证明工艺验证通过,但第5批失败了,则前面所有的批次都不可用。
除了验证次数和批次这两个容易混淆的概念之外,工艺验证的类型和方式这两个概念也容易让人产生混淆:
工艺验证类型指工艺验证性质类型,立足于工艺验证自身属性;
工艺验证方式指工艺验证实施方式,立足于工艺验证实施方法。
4、验证类型
基于GMP附录《确认与验证》第十九条可知,工艺验证包括四种类型,分别是首次验证、变更后验证、必要的再验证和持续工艺确认。
现在针对这四种类型工艺验证进行逐条说明:
首次验证:指新的生产处方或生产工艺开发、设计完成后进行的第一次验证。首次验证应涵盖该产品的所有规格。
变更后验证:是指影响产品质量的重大变更后的验证,用于验证变更对生产工艺以及产品质量的影响。
必要的再验证:是指在工艺验证后,维护验证状态过程中,通过定期的回顾和评估,认为有必要的时候,进行的再次验证工作,以证明验证状态持续有效。对于关键生产工艺,需进行周期性的再验证。
持续工艺确认:随着产品生命周期概念的引入,而产生的概念。指的是对商业化生产的产品质量进行监控和趋势分析,以确保在产品生命周期整个商业阶段,工艺和产品质量始终处于受控状态。为此,可建立系统识别非预期工艺波动,收集和评估工艺性能的数据和信息,识别问题,分析原因,制定应对措施。持续工艺确认的结果可用于支持产品质量回顾,确定工艺验证处于受控状态,由此可知,持续工艺确认可为再验证提供数据支持和评估结果。
用一张图表示这四种工艺验证的关系,是这样的:

针对首次验证之外的验证类型,企业也基于风险评估的结果采取简略的方式进行,比如选取代表性的产品规格、最差工艺条件、或适当减少验证批次。
实例说明
产品名称:阿莫西林胶囊
规格:0.125g、0.25g、0.5g
验证类型:
当开发了新的阿莫西林胶囊处方后,进行首次工艺验证时,需针对0.125g、0.25g、0.5g三种规格的产品,分别进行连续三批的工艺验证。待申报获批后,进行常规商业化生产阶段,在进行周期性再验证时,经过风险评估,可以采用最小规格0.125g进行连续三批进行验证,而无需再进行0.25g和0.5g两个大规格的再验证。
5、验证方式
工艺验证可采三种方式进行,分别为前验证、同步验证和回顾性验证。
前验证:又称前瞻性验证,也是日常工作中最常用到的验证方式,通常所说的工艺验证默认采用前验证方式进行。该验证方式适用于新的生产工艺或当工艺发生重大变化时所进行的工艺验证。验证成功后方可进行产品放行。
同步验证:指在常规生产过程中进行验证,仅适用于非常特殊的情况,比如药品短缺而临床急需的情况;市场需求量极小而无法进行连续批验证的情况,如孤儿药;以及产量极小的情况,如放射性药品。考虑到同步验证时,工艺和质量评价尚未全部完成,因此其决定必须合理、有文件记录并经过质量管理负责人批准,其产品应受到更加严格的监控。
回顾性验证:指针对某些历史遗留的产品,它们获批后一直在生产销售,但受限于当时的法规缺失验证的概念或要求,始终没有进行过严格意义上的工艺验证。这类产品,当期满足一系列条件时,才可以通过对历史数据回顾的方式进行回顾性验证,所涉及的过程包括准备验证方案、报告数据回顾的结果、做出相应的结论和建议。回顾性验证中所选的批次应能代表回顾周期内生产的所有批次,并且批次数量应足够多,通常需要10~30个连续批次。
考虑到这类产品历史悠久,且在长期生产过程中不免会出现调整或变更,因此能满足回顾性验证条件的并不多。另外,在2010版GMP的附录《确认与验证》中并未提及这种验证方式,美国FDA最新的工艺验证指南中同样没有出现,但欧盟GMP附录15《确认与验证》中已明确指出不在接受这种验证方式。因此,不再建议使用回顾性验证对历史遗留产品进行验证,建议基于最新要求进行必要的工艺优化和产品升级。
一、验证前提
工艺验证是个系统工程,为保证其有效性,在进行之前需完成必要的准备工作,也就是工艺验证的前提条件,主要前提条件包括:
1)所有参与验证的设备、设施、系统、检测仪器都必须完成确认,并在验证方案中体现确认完成情况;
2)所有支持性程序,如设备清洁、过滤、灭菌,都经过确认或验证;
3)关键仪表需在校验有效期内;
4)检测方法完成制定,并经过确认或验证;
5)原辅包、中间产品及成品的质量标准完成签批;
6)工艺验证涉及的原辅包完成采购,以及入厂检验;
7)工艺验证方案、批记录以及相关的操作规定完成签批;
8)参与工艺验证的人员完成培训,并填写培训记录。
这些大家看起来很熟悉的文件,更多是工艺验证显性的前提条件,而每一个条件里又蕴藏着很多隐性的前提条件,比如分析方法确认和验证本身就是一个系统工程,而且不同的方法需要考察不同的验证指标和限度要求,这些内容的确定和实施就是这一显性条件的前提;再比如工艺验证方案的签批,虽然输出的成果是一个看得见的文件,但是这个文件里却蕴含着丰富的内涵和前提,包括验证前的风险评估、验证所需设备的确认及校验情况、取样计划如何制定、考察参数有哪些以及确定依据,等等。
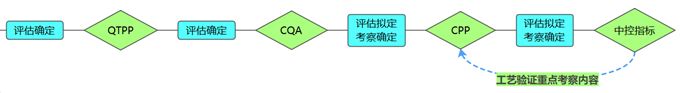
关于这些隐性前提条件,由于内容过于丰富就不再全面介绍,只针对其中非常关键的一个进行说明——风险评估。说到风险评估,可能较为普遍的看法是:一个玄乎其玄的东西,凭空想想,列出几条风险和对应措施就可以了。一些比较严谨或资深的同行,或许会认真的按照ICH Q9《质量风险管理》相关流程进行。对于工艺验证的风险评估,我不想说些常规的,而是倾向于从QbD理念出发,简单分享一下通过风险评估确定工艺验证考察因素的思路。思路流程图如下:
可以说工艺验证考察的内容,大都需要通过风险评估来确定,而所有的风险评估都要基于其在生产工艺中发挥的作用和对产品质量的影响程度进行,基于不同的影响程度,制定不同的控制程度。
二、验证批量
基于《GMP附录:确认与验证》第二十二条:工艺验证批的批量应当与预定的商业批的批量一致。
这句话看似明确了工艺验证批批量的要求,其实内部暗含着很多概念,而这些概念可通过对注册批批量、工艺验证批批量、预定商业批批量、商业批批量这四个概念的界定及关系来明确。
注册批可以是中试批,也可也是工艺验证批,所以注册批批量未必等于工艺验证批批量,考虑到中试批批量一般不会大于工艺验证批批量,因此注册批批量与工艺验证批批量的关系为:注册批批量≤工艺验证批批量。
注册审评时,以注册批批量来确定批准的批量,即首次批准可用于商业生产的批量等于注册批批量。申请人(一般为药企)若认为注册批批量可满足商业需求,则可以沿用,此时注册批批量等于商业批批量;若认为注册批批量太小,不足以满足商业需求(这种情况多发生在以中试批或临床批作为注册批的情况;以工艺验证批作为注册批的时候,也偶有发生),则可以在获批后进行批量变更,扩大商业批批量,此时注册批批量<商业批批量。
工艺验证批批量等于预定商业批批量,这一点很明确。
至于预定商业批和商业批,顾名思义,前者是预定的,在申报之前确定,后者是实际的,在申报之前预定,但申报之后有可能保持,也有可能改变,因此两者有可能一样,也有可能不一样。若不一样,一般要备案或补充申请。
由此可知,上述四种批量一般的大小关系为:
三、验证内容
如前文所述,工艺验证不是一次性工作,而是贯穿产品生命周期整个过程,但整个产品生命周期中的工艺验证,并非一成不变,而是随着工艺认知的深入、生产经验的丰富、风险评估的针对性增强进行相应的设计和调整的。比如,一些因素,如湿法制粒中颗粒的粒径分布,在初始评估期间,认为对生产工艺影响不大,但随着长期生产暴露出的问题,发现其有可能影响工艺稳定性,则需要进行评估确认,以及必要的验证。
工艺验证常规的考察因素,包括但不限于以下内容:
1)关键物料及关键物料属性CMA
关键物料的判定特征包括:其波动可能对产品质量产生不良影响;其决定产品的某些关键属性,比如缓释材料之于缓释制剂。
为了考察关键物料,在工艺验证中尽可能使用多个批次。
2)设备及设备参数
设备确认是工艺验证的前提条件,同时设备参数也是工艺验证的考察因素。在验证之前应确认所涉及的所有设备以及关键设备的参数设置。设备的参数需要满足工艺验证的要求,在某些情况,验证会涉及设备参数的“最差条件”,即最有可能产生质量问题的参数设定条件。
3)关键工艺参数CPP
如上所述,CPP由风险评估拟定并经试验确定。在进行工艺验证时,需对每个CPP设定特定的接受标准。
4)中控指标
如上所述,中控指标由风险评估拟定并经试验确定。在进行工艺验证时,需对中控指标进行检验评估。
5)中间体及产品质量检验
在工艺验证过程中,需基于相应的质量标准,对中间产品和产品进行检验,以评估其是否满足标准要求。
6)取样计划及取样
工艺验证的取样要比常规生产更加严格和频繁,因此,在工艺验证时,应制定书面的取样计划,并按计划和要求进行取样检验。取样计划应包括取样时间、方法、人员、工具、位置、取样量、取样方式等。
7)稳定性考察
所有验证批次都需经过风险评估确定是否进行稳定性考察,以及考察的类型、条件及范围。一般而言,首次验证需进行全面的稳定性考察,再验证可酌情进行。
针对不同的剂型和生产工艺,验证需要考察的具体因素和指标往往存在差异,因此需要具体项目具体分析。
四、验证文件
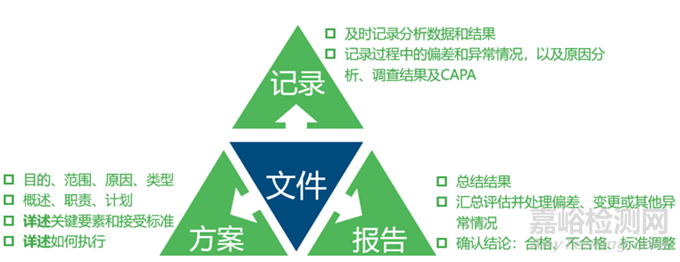
作为药品研发生产过程中极为重要的一项工作,工艺验证需要配备完善的文件记录体系。基于以下原则:
所有的验证活动都应有组织地按照计划进行准备和执行,并且活动应按照正式批准的程序和方法实施。
工艺验证前需要正式批准验证方案,作为验证实施的具体依据;验证过程中需要按要求及时、准确、完整的填写批记录;验证完成后需及时汇总和分析数据,得出结论,形成报告并完成签批。由此可以得出工艺验证的三类文件:验证方案、批记录、验证报告。
工艺验证方案和报告内容详细对比:
工艺验证方案
工艺验证报告
1. 工艺的简短描述(包括批量等);
2. 关键质量属性的概述及可接受限度;
3. 关键工艺参数的概述及其范围;
4. 应当进行验证的其他质量属性和工艺参数的概述;
5. 所要使用的主要的设备、设施清单以及它们的校准状态;
6. 成品放行的质量标准;
7. 相应的检验方法清单;
8. 中间控制参数及其范围;
9. 拟进行的额外试验、测试项的可接受标准和已验证的用于测试的分析方法;
10. 取样方法及计划;
11. 记录和评估结果的方法(包括偏差处理)
12. 职能部门和职责;
13. 建议的时间进度表。
1. 题目、批准日期和文件编号;
2. 验证目标和范围;
3. 实验实施的描述;
4. 结果总结及分析;
5. 结论;
6. 偏差和解决方法;
7. 附件(包括原始数据);
8. 参考资料(包括验证方案号和版本号);
9. 对需要纠正缺陷的建议。
这三类文件的内容概况如下: