今日头条
康方PD-1单抗报鼻咽癌NDA。康方生物PD-1单抗派安普利单抗注射液(安尼可®)的新适应症上市申请获CDE受理,联合化疗一线治疗复发或转移鼻咽癌(NPC)。目前,该新药在国内已获批两项适应症:派安普利单抗联合化疗一线治疗局部晚期或转移性鳞状非小细胞肺癌,以及派安普利单抗治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤。派安普利单抗三线治疗NPC的上市申请正接受CDE的监管审查。
国内药讯
1.绿叶引进肺癌新药澳门获批上市。绿叶制药宣布其引进新药“注射用芦比替定”获得澳门药监部门批准上市,用于治疗接受铂类药物化疗期间或期后出现疾病进展的转移性小细胞肺癌(SCLC)成人患者。这是一款RNA聚合酶II抑制剂,能够选择性地抑制多种肿瘤所依赖的致癌基因转录。值得一提的是,该产品目前正在接受CDE和香港药监部门的上市监管审查。
2.士泽iPS衍生细胞疗法获ALS孤儿药资格。士泽生物开发的诱导多能干细胞(iPSC)衍生亚型神经前体细胞疗法获FDA授予孤儿药资格,拟用于治疗肌萎缩侧索硬化症(ALS,又称“渐冻症”)。这是该公司首个候选产品,旨在通过iPSC在体外再生健康的细胞进行替代性疗法,为神经系统疾病患者提供全新的治疗选择。目前,该公司已完成超2亿元A1轮融资及A2轮追加投资。
3.科济GPRC5D靶向CAR-T获批临床。科济药业靶向GPRC5D的自体CAR-T细胞候选产品CT071获FDA批准,即将在美国开展用于治疗复发/难治多发性骨髓瘤(MM)或复发/难治原发性浆细胞白血病(PCL)的临床研究。CT071正在国内开展一项研究者发起的用于MM或PCL治疗的临床试验(IIT)。初步数据显示,CT071具有可接受的安全性和初步疗效。
4.百济神州HPK1抑制剂国内获批临床。百济神州HPK1抑制剂BGB-26808获国家药监局临床试验默示许可,拟开发单药治疗晚期实体瘤。HPK1是T细胞受体(TCR)信号通路下游的一种激酶,被认为在激活T细胞的过程中起到关键作用。目前,该新药正在澳大利亚、新西兰开展一项Ⅰ期临床,评估单药或与替雷利珠单抗联用治疗晚期实体瘤的安全性、耐受性、药代动力学和初步抗肿瘤活性。
5.普众发现MUC18靶向ADC获批临床。普众发现医药(上海)1类生物药“注射用AMT-253”获国家药监局临床默示许可,拟用于晚期实体瘤的治疗。AMT-253是一款靶向MUC18的ADC药物,旨在通过DNA损伤和细胞凋亡表现出MUC18特异性的细胞毒性和强大的旁观者杀伤效应。在临床前研究中,AMT-253在黑色素瘤、宫颈鳞癌、头颈鳞癌、食管鳞癌、肺鳞癌、小细胞肺癌、卵巢癌、肝癌等多种CDX或PDX模型中均显示出积极的抑肿效果。
6.再鼎DLL3靶向ADC报IND。再鼎医药1类生物制品注射用ZL-1310(YL212)的临床申请获CDE受理。YL212是基于宜联生物自有的TMALIN®平台所开发的DLL3 ADC。DLL3是一种在小细胞肺癌 (SCLC) 和神经内分泌肿瘤中过度表达的Notch配体抑制剂。今年4月,再鼎医药与宜联生物达成战略合作和许可协议,获得YL212的全球开发及商业化独家权益。
国际药讯
1.吸入性mRNA疗法获批英国Ⅰ期临床。Ethris GmbH公司编码III型干扰素(IFN)的吸入性mRNA疗法获英国药品和保健品监管局(MHRA)批准,即将在健康受试者中开展Ⅰ期临床,评估用于治疗和预防呼吸道病毒感染的安全性与初步疗效。ETH47旨在诱导病毒进入部位的粘膜产生先天性免疫防御反应,并抑制病毒复制。ETH47有望广泛用于季节性和新出现的呼吸道病毒感染,包括由病毒引起的哮喘等慢性呼吸道疾病的恶化。
2.FASN抑制剂联合治疗NASH临床前研究积极。Sagimet公司新型脂肪酸合成酶(FASN)抑制剂TVB-3664与semaglutide联合治疗非酒精性脂肪性肝炎(NASH)的临床前研究结果积极。在NASH小鼠模型中,与TVB-3664单药相比,semaglutide治疗组动物体重减轻更多,其肝损伤的生物标志物水平较低;与TVB-3664或semaglutide单药相比,TVB-3664+semaglutide治疗在改善肝纤维化生物标志物上效果更佳。研究成果日前公布于肥胖和NASH药物研发峰会上。
3.FIC抗炎药治疗痴呆的III期临床失败。Biovie公司靶向结合细胞外信号调节激酶的“first-in-class”口服抗炎候选药物NE3107,在治疗潜在轻中度阿尔茨海默病(AD)的III期NM101研究未达到主要终点。在修正后的意向性治疗(MITT)人群中,与安慰剂相比,NE3107治疗改善了患者的CDR-SB评分、ADAS-Cog 12评分、MMSE评分、ADCS-ADL评分、ADCS-CGIC评分和ADCOMS评分等指标,但不具统计学意义。受此影响,当天该公司股价下跌65%。
4.辉瑞终止小分子GLP-1R激动剂III期开发。辉瑞口服小分子GLP-1受体激动剂Danuglipron(PF-06882961)每日两次(BID)给药治疗肥胖(非2型糖尿病)患者的IIb期临床(NCT04707313)达到主要终点。与安慰剂相比,Danuglipron治疗组患者第32周和第26周时体重下降幅度分别为8%-13%,和5%-9.5%;研究中没有新的安全性信号,Danuglipron治疗与肝酶升高发生率增加无关。但辉瑞表示,不计划将Danuglipron(BID)推进至III期临床阶段。
5.罗氏31亿美元收购Carmot Therapeutics。罗氏宣布收购Carmot公司,并获得该公司开发拟用于治疗糖尿病和非糖尿病患者肥胖症的临床期肠促胰岛素产品组合(GLP-1/GIP受体双激动剂CT-388;口服小分子GLP-1R激动剂CT-996;皮下注射双重GLP-1/GIP受体激动剂CT-868),以及多项临床前资产。根据协议,罗氏将支付27亿美元的预付款和高达4亿美元的里程碑后期付款。该项交易预计明年第一季度完成。
6.强生医疗科技收购Laminar公司。强生医疗科技宣布完成对私营医疗器械公司Laminar的收购。Laminar专注于开发用于左心耳封堵(LAA closure) 以降低非瓣膜性房颤(AFib)患者卒中风险的创新研究装置。Laminar的创新研究装置旨在非药物替代慢性口服抗凝药物,有望为不能耐受长期血液稀释剂的AFib患者提供新的治疗选择。根据协议,Laminar公司获得4亿美元的预付款,以及临床和监管里程碑潜在后期付款。
医药热点
1.国家卫健委建立全国地贫防控协作网。为进一步加大地贫防控力度,近期国家卫健委印发通知,在10个省份遴选101家医疗机构组建全国协作网,旨在进一步发挥优质医疗资源辐射带动作用,推进落实防控、诊疗、协作、保障、病例登记和科学研究6项任务。协作网以南方医科大学南方医院、广西医科大学第一附属医院为国家级牵头单位,四川大学华西第二医院为全国信息管理依托单位。
2.我国未发现新病毒或细菌导致的新发传染病。12月2日,国家卫健委举行新闻发布会,介绍冬季呼吸道疾病防治有关情况。国家卫健委新闻发言人、宣传司副司长米锋在会上表示,根据监测,目前流行的急性呼吸道疾病均由已知病原体引起,都有相应的成熟治疗手段,未发现新病毒或细菌导致的新发传染病。
3.超声波技术实现无创“读脑”。美国加州理工学院研究人员最新发表于《自然·神经科学》上一项新研究显示,无需开颅植入电极的功能性超声(FUS)技术可以成为一种“在线”脑机接口(BMI)的基础,这种BMI可以读取大脑活动,通过用机器学习编程的解码器破译其含义,从而控制一台延时极短、可准确预测运动的计算机。神经元活动的变化会引起它们对氧气等代谢资源的利用发生变化。这些资源通过血液重新补充,这是功能性超声波的关键。
评审动态
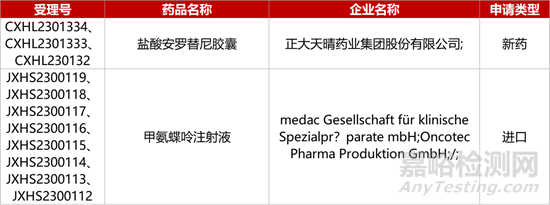
1. CDE新药受理情况(12月04日)
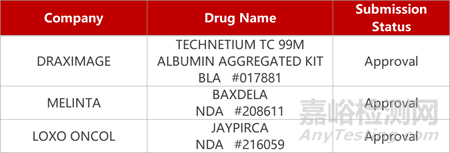
2. FDA新药获批情况(北美12月01日)