今日头条
纽福斯眼科基因疗法获批ADOA临床。纽福斯生物眼科基因治疗产品NFS-05获澳大利亚治疗用品管理局(TGA)批准,即将开展用于治疗显性遗传性视神经萎缩(ADOA)的临床试验。NFS-05利用腺相关病毒 (AAV) 为载体,通过玻璃体内注射,将OPA1基因递送至患者视神经节细胞,修复线粒体功能,以恢复患者视力。目前临床上尚无针对ADOA的有效治疗手段。
国内药讯
1.璎黎PI3Kδ抑制剂新适应症报产。璎黎药业PI3Kδ抑制剂林普利塞片新适应症上市申请获CDE受理,推测申报的适应症为“复发/难治性外周T/NK细胞淋巴瘤经治患者”。林普利塞片是首个国产PI3Kδ抑制剂,此前已获国家药监局附条件批准上市,商品名:因他瑞,用于治疗复发或难治滤泡性淋巴瘤(FL)。恒瑞医药拥有林普利司在大中华地区的联合开发权益以及排他性独家商业化权益。
2.腾盛博药HBV免疫疗法Ⅱ期临床积极。腾盛博药与VBI Vaccine合作开发的免疫疗法BRII-179(VBI-2601)联合标准疗法聚乙二醇干扰素⍺(PEG-IFN⍺)治疗慢性乙型肝炎(CHB)的Ⅱ期研究期中结果积极。与安慰剂+PEG-IFNα方案相比,BRII-179组合在治疗结束(第24周)时和治疗结束后12周随访(第36周)时,达到HBsAg清除的患者比例显著更高(32.6%vs21.6%;31.8%vs14.9%)。治疗结束时,BRII-179治疗组实现HBsAg清除的15例患者中,有9例达到HBsAg血清学转换(vs1例)。
3.河南中帅多动症儿童用药拟纳入优先审评。中帅药业自主研发生产的中枢兴奋剂盐酸右哌甲酯缓释胶囊被CDE以“符合儿童生理特征的儿童用药品新品种、剂型和规格”为由拟纳入优先审评,用于治疗注意缺陷多动障碍(ADHD,俗称多动症)。该产品是一种哌甲酯外消旋的d-苏式对映体,通过抑制去甲肾上腺素和多巴胺的再摄取而起作用。
4.和正BTK抑制剂拟纳入突破性品种。和正医药1类化药HZ-A-018胶囊获CDE拟纳入突破性治疗品种,适应症为“复发或难治性原发中枢神经系统淋巴瘤”。HZ-A-018是一款血脑屏障高渗透性的选择性BTK抑制剂,此前已获NMPA批准开展B细胞淋巴瘤、复发难治性中枢神经系统淋巴瘤(PCNSL)、原发免疫性血小板减少症(ITP)、复发型多发性硬化(RMS)和视神经脊髓炎谱系疾病(NMOSD)的临床试验。
5.易慕峰CAR-T获胰腺癌孤儿药资格。易慕峰公司基于其合成性天然杀伤受体(SNR)技术平台研发的新一代自体CAR-T产品IMC008获FDA授予孤儿药资格,用于治疗胰腺癌患者。SNR平台通过双重识别及功能加强机制,不仅能靶向特定抗原,还能通过SNR受体拓展CAR-T细胞的抗原识别范围,有效解决肿瘤抗原异质性所带来的挑战。今年8月,FDA已授予该产品用于治疗胃癌的孤儿药资格。
国际药讯
1.杨森EGFR/c-MET双抗肺癌Ⅲ期临床积极。强生旗下杨森EGFR/c-Met双抗药物Rybrevant(amivantamab)与化疗(卡铂和培美曲塞)、和(或无)口服酪氨酸激酶抑制剂(TKI)lazertinib联合治疗局部晚期或转移性非小细胞肺癌(NSCLC)的Ⅲ期临床MARIPOSA-2达到双重主要终点。与单独化疗相比,Rybrevant(伴和不伴lazertinib)和化疗两种方案均显著提高奥希替尼耐药后、带有EGFR ex19del或L858R突变的NSCLC患者的无进展生存期(PFS);临床中并没有发现新的安全性信号。详细结果将公布于科学大会上。
2.雀巢减肥胶囊关键研究成功。Epitomee Medical公司与雀巢合作开发的医疗设备“减肥胶囊”在用于超重和轻度肥胖人群的关键试验获积极结果。“减肥胶囊”含有可膨胀的生物聚合物,服用之后在胃部可膨胀成一个灵活的三角形,使胃部产生饱腹感,以帮助患者减重。该项研究预设的指标为“35%受试者至少减掉基线体重的5%”。两家公司计划通过510(k)途径向FDA递交其上市申请。
3.BioCardia公司干细胞疗法III期试验失败。BioCardia公司自体骨髓干细胞疗法CardiAMP通过心脏导管介入微创手术进行细胞移植来治疗心力衰竭的III期试验未达到主要终点。与对照组相比,BioCardia治疗组患者在一年内的死亡率(5.5%VS5.3%)、主要心血管事件(16.7%VS15.8%)和6分钟步行测试(36.1米 vs33.4米)无统计学显著性差异。受此消息影响,BioCardia股价下跌26%,目前市值仅1680万美元。
4.FDA拒批C5抑制剂治疗NMOSD。阿斯利康长效C5补体抑制剂Ultomiris(ravulizumab-cwvz)用于治疗抗水通道蛋白4(AQP4)抗体阳性(Ab+)视神经脊髓炎(NMOSD)补充生物制品许可申请(sBLA)收到FDA完整回复函(CRL)。FDA要求阿斯利康修改Ultomiris的风险评估和减轻策略(REMS),以进一步确认患者脑膜炎球菌疫苗接种状况,以及治疗前预防性使用抗生素情况。在III期CHAMPION-NMOSD研究中,中位治疗为73周时,Ultomiris较安慰剂降低了98.6%(p<0.0001)的疾病复发风险。
5.Rejuvenation融资开发端粒酶mRNA疗法。Rejuvenation公司宣布募集了460万美元的研究基金,以及完成了由Khosla Ventures领投的1060万美元种子轮融资。该公司基于定制组织靶向脂质纳米颗粒(LNP)技术开发的先导项目核苷修饰mRNA疗法,能够编码端粒酶逆转录酶(TERT)延长端粒,逆转“端粒缩短”这一衰老的根本标志,用于肺纤维化和肝衰竭的治疗。募集的资金将用于推进优化端粒酶mRNA疗法的IND批准,以及针对免疫系统的早期研究。
6.罕见病药物公司完成9千万美元C轮融资。致力于血液学和免疫学领域的Star Therapeutics公司宣布完成9000万美元的超额认购C轮融资。Star Therapeutics是由多家公司组成的公司联盟,该公司的研发策略是针对多种罕见疾病的共同生物学特性,开发出用于多种疾病的新型单一疗法。此轮融资将用于支持评估抗体疗法VGA039治疗血管性血友病的Ⅰa/Ⅰb期临床开发,以及发展旗下投资组合公司。
医药热点
1.Patrick Horber博士将出任诺华国际部总裁。诺华宣布其创新药物国际部总裁兼首席商务官Marie-France Tschudin即将在9月15日起正式卸任,并退出诺华执行委员会(ECN);医学博士Patrick Horber将被任命为国际部总裁,上任后直接向诺华首席执行官、医学博士Vas Narasimhan汇报工作。Horber博士现任为艾伯维高级副总裁兼免疫学总裁,负责免疫学业务部,领导全球战略和美国执行,包括全球商业开发。
2.Cell子刊:膳食补充抗性淀粉可减轻脂肪肝。上海第六人民医院贾伟平、李华婷教授联合德国汉斯诺尔研究所的研究人员最新在" Cell Metabolism "期刊上发表的研究成果显示,富含抗性淀粉的饮食,可以改变肠道细菌组成,并降低与肝损伤、炎症相关的甘油三酯以及肝酶水平,改善脂肪肝,并且这种改善与体重变化无关。
3.我国首个脓毒症诊疗团体标准发布。近日,由郑州大学第一附属医院牵头起草的《脓毒症诊断与治疗规范》团体标准获中国研究型医院学会批准发布,于8月30日起开始实施。该标准规定了脓毒症与脓毒性休克的定义,脓毒症临床诊断及病因诊断、鉴别诊断,并从治疗原则、感染源控制、抗感染治疗、液体复苏、血管活性药物及对症支持治疗等方面规定了脓毒症的治疗要求。
评审动态
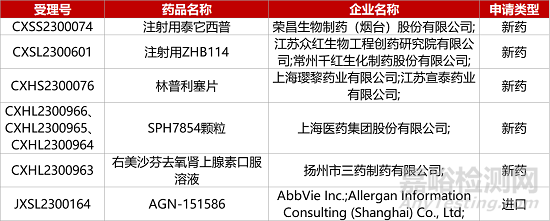
1. CDE新药受理情况(09月07日)
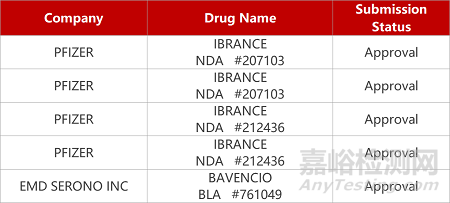
2. FDA新药获批情况(北美09月06日)