今日头条
瓴路药业CD19靶向ADC报产。瓴路药业与ADC Therapeutics开发的靶向CD19抗体偶联药物注射用泰朗妥昔单抗(Loncastuximab tesirine)上市申请获CDE受理,用于单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)。在II期OL-ADCT-402-001研究中,该新药的有效性与安全性数据与全球关键临床结果一致。Loncastuximab tesirine是全球唯一个靶向CD19的ADC药物,已获FDA加速批准上市,用于治疗至少接受过2线及以上系统治疗的R/R DLBCL患者。
国内药讯
1.第一三共HER2-ADC中国获批新适应症。第一三共与阿斯利康开发的HER2-ADC新药德曲妥珠单抗(DS-8201)获国家药监局批准新适应症,用于治疗HER2低表达(IHC 1+或IHC 2+/ISH-)不可切除或转移性乳腺癌经治患者。在III期DESTINY-Breast04研究中,Enhertu与化疗相比,使这类患者的疾病进展或死亡风险显降低49%(p<0.001)。这是该新药在中国获批的第2项适应症,该产品也是中国首款针对HER2低表达乳腺癌靶向药。
2.葛兰素史克抗HIV新药中国获批上市。葛兰素史克(GSK)HIV新药卡替拉韦注射液和卡替拉韦钠片获国家药监局批准上市。卡替拉韦(cabotegravir,曾用名:卡博特韦)是一种整合酶抑制剂,已先后在欧盟、美国和日本获批上市,用于治疗HIV-1感染患者及HIV的暴露前预防。值得一提的是,该药物每月1次和两个月一次的给药方案均获得FDA批准。
3.默沙东3组分抗生素复方中国报产。默沙东抗生素复方制剂注射用亚西瑞来(亚胺培南/西司他丁/瑞来巴坦)的上市申请获得CDE受理,推测申报的适应症为呼吸机相关性细菌性肺炎(VABP)和医院获得性细菌性肺炎(HABP)。在III期临床中,与哌拉西林+他唑巴坦治疗组相比,亚西瑞来治疗28天内显著降低了患者全因死亡率(15.9%vs21.3%)。
4.沙砾基因编辑TIL产品获批临床。沙砾生物自研、表达膜结合细胞因子的下一代基因编辑型TIL产品GT201获国家药监局批准,即将开展用于复发或转移性实体瘤的Ⅰ期临床。在研究者发起的临床试验(IIT)中,GT201已在多例晚期实体瘤患者中显示出良好的安全性,并展示出稳定地扩增和初步临床疗效。值得一提的是,沙砾生物开发的国内首个TIL药物GT101已于2022年4月获批进入临床,目前即将进入关键Ⅱ期临床开发。
5.和泽第3款GLP-1R/GIPR激动剂获批临床。和泽医药1类化药HZ012注射液获国家药监局临床试验默示许可,拟开发用于BMI在28kg/m2及以上(肥胖)或BMI在24kg/m2及以上(超重)并伴有至少一种肥胖合并症的成人患者,辅助低热量饮食和增加锻炼进行体重管理。HZ012是和泽医药第3款获批临床的GLP-1R/GIPR激动剂。此前,该公司已有两款同类产品HZ010和P29分别在国内获批临床许可。
6.泽布替尼在美报滤泡性淋巴瘤NDA。百济神州BTK抑制剂泽布替尼(百悦泽)的第5项适应症上市申请获FDA受理,联合奥妥珠单抗用于治疗既往至少经过二线治疗后复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。在II期ROSEWOOD研究中,与奥妥珠单抗单药相比,泽布替尼联合治疗提高了患者总缓解率(68.3%vs45.8%,p=0.0017)。FDA预计将于明年第一季度作出审批决定。
国际药讯
1.芦可替尼乳膏儿童皮炎Ⅲ期试验积极。Incyte公司JAK1/JAK2抑制剂Opzelura(ruxolitinib)乳膏治疗特应性皮炎(AD)儿童患者的Ⅲ期临床TRuE-AD3结果积极。与对照组相比,Opzelura(0.75%和1.5%)治疗组达到皮肤症状完全清除或皮肤症状几乎完全清除且在第8周时比基线至少改善两分的患者比例显著更高。Opzelura总体安全性与已知研究一致,未发现新的安全信号。2021年,它已获得FDA批准用于12岁以上轻中度特应性皮炎患者。
2.粪菌移植联合免疫疗法黑色素瘤早期临床积极。加拿大劳森健康研究所(LHSC)、蒙特利尔大学中心医院(CHUM)和犹太总医院联合开发的源自健康供者的粪便菌群移植(FMT)胶囊用于改善晚期黑色素瘤患者对免疫疗法的反应的Ⅰ期临床结果积极。患者在一个疗程中口服下约40个粪便移植胶囊之后接受免疫治疗,结果显示所有患者没有产生任何感染性微生物;患者的客观缓解率达到65%(黑色素瘤患者对免疫疗法的反应率通常只有40%-50%)。在中位随访为20.7个月时,所有16例患者仍存活。
3.湃隆生物CDK7抑制剂上Ⅰ期临床。湃隆生物(Apeiron Therapeutics)与Exscientia公司合作开发小分子非共价结合细胞周期蛋白依赖性激酶7(CDK7)抑制剂GTAEXS617,在用于治疗晚期实体肿瘤的Ⅰ/Ⅱ期ELUCIDATE临床完成首例受试者入组。GTAEXS617能够干扰肿瘤细胞的细胞周期并抑制转录过程,有望为包括头颈癌、结直肠癌、胰腺癌、非小细胞肺癌(NSCLC)、HR+/HER2-乳腺癌和卵巢癌等实体瘤患者提供差异化的治疗选择。
4.安斯泰来超9亿美元开发罕见眼病基因疗法。安斯泰来与4D Molecular Therapeutics将利用后者玻璃体内R100载体技术,针对罕见单基因眼病相关靶点,合作开发新型基因治疗药物。R100是一种AAV载体,能够通过玻璃体内注射有效转导至整个视网膜,从而在视网膜细胞内实现转基因表达。根据协议,4DMT将获得2000万美元的预付款,高达9.425亿美元的期权费和里程碑潜在付款,包括针对初始靶点的1500万美元的开发里程碑付款。
5.GSK布局开发新型寡核苷酸药物。葛兰素史克与Elsie Biotechnologies将利用后者专有寡核苷酸发现平台,结合GSK的DNA编码文库(DEL)技术,合作开发新型寡核苷酸治疗候选药物。GSK还将应用Elsie专有的P(V)化学技术,包括一套新型试剂和工艺,以完全合成控制的方式来合成多种寡核苷酸疗法。根据协议,Elsie将获得一笔合作预付款,非独家许可费,以及进一步开发和商业里程碑潜在付款。
6.FDA暂停一款CAR-T疗法AML临床试验。Hemogenyx公司基于慢病毒开发的自体HEMO-CAR-T细胞疗法用于治疗急性髓系白血病 (AML)的临床研究已被FDA叫停。HEMO-CAR-T使用 Hemogenyx 专有的人源化单克隆抗体,能够针对AML细胞上的独特抗原。试验暂停原因是由于慢病毒生产过程中出现的“剪接缺陷”。Hemogenyx首席执行官Vladislav Sandler日前表示,该公司有信心解决FDA对HEMO-CAR-T的研究性新药 (IND) 申请所担忧的安全问题。
医药热点
1.华盛顿大学研发出“医用微型相机胶囊”。近日,乔治华盛顿大学的研究人员开发出一种可吞咽的胶囊,其中包含一个摄像机,可以帮助识别胃中病变。这种胶囊可以在临床医生的遥控下在胃内进行全面筛查,以识别胃粘膜中包括溃疡或出血等任何健康问题。在临床研究中,与传统内窥镜检查相比,医生可以准确控制胶囊到达胃部所有主要部位,可视化成功率高达95%。
2.四川出台方案招聘大学生乡村医生。近日,四川省卫健委等部门联合印发《四川省大学生乡村医生专项计划实施方案》。《实施方案》旨在通过社会招聘一批服务乡村医疗卫生机构的大学生,服务乡村医疗卫生机构,提高乡村医疗卫生机构医生学历,解决乡村卫生队伍老龄化、人员“断档”等问题,提高乡村医疗服务能力和专业水平,满足人民日益增长的医疗服务需求。
3.西安交大一附院头痛中心成立。近日,中国头痛防控基地及体系建设(西安站)暨西安交大一附院头痛中心授牌仪式在西安召开,交大一附院作为西北地区唯一一家头痛防控专家委员会单位,成为全国首批国家级头痛中心。本次头痛中心挂牌,标志西安交通大学第一附属院神经内科头痛亚专科具有一定影响力,日后将继续大力推广应用头痛诊疗新进展,优化头痛疾病诊断与治疗流程,发挥优势学科力量,有力推动神经内科的发展,助力国家医学中心和国家神经疾病区域医疗中心建设。
评审动态
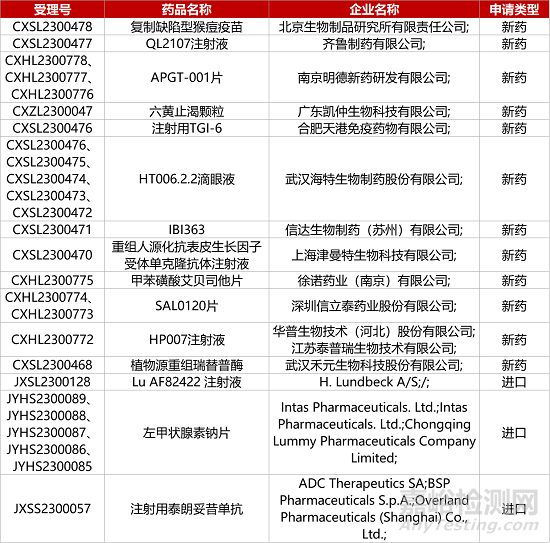
1. CDE新药受理情况(07月14日)
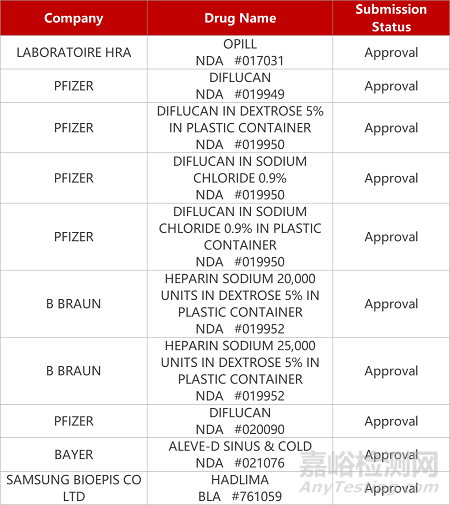
2. FDA新药获批情况(北美07月13日)