今日头条
和誉CSF-1R抑制剂Ib期临床积极。和誉医药创新CSF-1R抑制剂Pimicotinib(ABSK021)在ASCO2023年会上公布用于治疗晚期腱鞘巨细胞瘤(TGCT)的Ib期研究结果。数据显示,Pimicotinib(50mg QD)剂量组达到77.4% (24/31)的客观缓解率(ORR),包括2例完全缓解(CR)和22例部分缓解(PR);有87.5%患者维持客观缓解长达25周;而且药物总体耐受性良好。此前,该新药已获得FDA和CDE授予突破性疗法认定。
国内药讯
1.传奇BMCA靶向CAR-T报sNDA。传奇生物与杨森联合开发的靶向BMCA的CAR-T疗法西达基奥仑赛(Carvykti)向欧洲药品管理局递交一项II类变更申请,拟扩展适应症,用于治疗既往接受过1-3线治疗后复发且来那度胺耐药的多发性骨髓瘤(r/r MM)成人患者。2022年5月,该药已获批欧盟附条件批准治疗r/r MM患者。在III期研究CARTITUDE-4中,与标准治疗组相比,Carvykti与泊马度胺、硼替佐米和地塞米松(PVd)治疗使患者的疾病进展/死亡风险降低了74%。
2.亚盛奥雷巴替尼拟纳入突破性治疗品种。亚盛医药第三代BCR-ABL抑制剂奥雷巴替尼(耐克替尼,商品名:耐立克)获CDE拟纳入突破性治疗品种,用于既往经过一线治疗的琥珀酸脱氢酶(SDH)缺陷型胃肠道间质瘤(GIST)。2021年11月,该药已获批用于治疗任何酪氨酸激酶抑制剂(TKI)耐药、被诊断为伴有T315I突变的慢性髓系白血病(CML)慢性期(CP)或加速期(AP)的成年患者。
3.和黄VEGFR抑制剂获FDA优先审评资格。和黄医药与武田联合开发的VEGFR抑制剂呋喹替尼获FDA授予优先审评资格,用于治疗难治性转移性结直肠癌,PDUFA日期为今年11月30日。在全球III期试验 (MRCT) FRESCO-2研究中,与安慰剂相比,呋喹替尼治疗组的mOS延长2.6个月,mPFS延长1.9个月。在中国,该新药已获批用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者。
4.艾码siRNA疗法获亨廷顿舞蹈症孤儿药资格。艾码生物宣布其基于体内自组装外泌体递送(IVSAED)技术开发的首个创新产品ER2001获得FDA授予孤儿药资格,用于治疗亨廷顿舞蹈症(HD)。ER2001旨在通过利用人体或动物体的自身器官组织作为生物反应器,在体内被 “加工”成为活性形式的siRNA,并组装进入“生物反应器”同步产生的中枢神经系统靶向的内源外泌体中,以降解神经元细胞的突变亨廷顿蛋白(mHTT)的mRNA来达到治疗目的。
5.百济神州PD-1单抗肺癌III期临床成功。百济神州PD-1抗体替雷利珠单抗(中文商品名:百泽安®)联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)患者的III期RATIONALE 312研究达到总生存期(OS)的主要终点。与化疗相比,替雷利珠单抗联合化疗显著延长患者的总生存期;临床中未发现新的安全性警示。完整数据将在医学会议上公布。目前,该药已有11项适应症获NMPA批准,其中9项适应症已纳入医保目录。
6.正大天晴引进NASH新药获批临床。Inventiva公司1类化药lanifibranor片获国家药监局临床试验默示许可,拟开发用于治疗伴有肝纤维化的非肝硬化非酒精性脂肪性肝炎(NASH)的成人患者。lanifibranor(拉尼兰诺)是一种口服过氧化物酶体增殖物激活受体(PPAR)激动剂,可同时激活PPARα、PPARδ和PPARγ,这些受体在调控脂质代谢、炎症反应和纤维化过程中发挥重要作用。正大天晴拥有该新药在大中华区的开发、生产和商业化权利。
国际药讯
1.SGLT1/2双重抑制剂获批治疗心衰。Lexicong公司口服SGLT1/2双重抑制剂Inpefa(sotagliflozin)获FDA批准上市,用于治疗具各种范围左心室射血分数的心力衰竭患者,包括射血分数保留型(HFpEF)和射血分数降低型(HFrEF)在内,且可用于有或无糖尿病的患者。在Ⅲ期临床(SOLOIST-WHF)中,与安慰剂相比,Inpefa显著降低患者因心力衰竭住院、因心力衰竭紧急就诊以及心血管死亡的复合风险达33%。
2.口服KIT/PDGFRα抑制剂获批治疗惰性SM。Blueprint公司口服KIT/PDGFRα抑制剂avapritinib(商品名:Ayvakit)的补充新药申请获FDA批准,用于治疗惰性系统性肥大细胞增多症(SM)患者。在Ⅱ期PIONEER临床中,与对照组相比,Ayvakit治疗组24周时患者的平均TSS改变具有统计学显著改善(下降15.6分vs下降9.2分,p=0.003);药物的耐受性良好。基石拥有该新药的大中华区权益。
3.新型反胃酸药物向FDA报NDA。Phathom公司钾离子竞争性酸阻滞剂(P-CAB)伏诺拉生(vonoprazan)重新向FDA提交新药申请,用于治疗糜烂性食管炎,也被称为糜烂性胃食管反流病(GERD)。在Ⅲ期临床中,与活性对照组相比,vonoprazan组第8周时患者的愈合率达到93%(vs85%,p<0.0001);治疗中/重度疾病患者第2周时患者的愈合率也更高(70%和53%)。如果获批,伏诺拉生将成为FDA批准的首个用于GERD的创新酸阻滞剂。
4.阿斯利康PD-L1单抗子宫内膜癌III期临床积极。阿斯利康PD-L1抗体Imfinzi(度伐利尤单抗)联合含铂化疗一线治疗晚期或复发子宫内膜癌患者,以及使用Imfinzi+Lynparza(奥拉帕利)或单药Imfinzi作为维持治疗的III期临床(DUO-E)达到主要研究终点。与标准治疗相比,Imfinzi联合标准治疗之后使用Imfinzi+Lynparza或Imfinzi维持治疗均显著改善患者无进展生存期,而且Imfinzi+Lynparza维持治疗的临床获益更大;总生存期数据尚不成熟。药物的安全性与之前研究一致。
5.Vandag公司晕车新药III期研究积极。Vandag公司神经激肽-1受体拮抗剂tradipitant(曲地匹坦)治疗晕动症(尤指晕车)的III期Motion Syros研究结果积极。365例晕动症患者分别在乘船旅行中接受170mg tradipitant、85mg tradipitant或安慰剂治疗。结果显示,170mg和85mg tradipitant剂量组预防呕吐的效果均显著优于安慰剂组,170mg和85mg tradipitant剂量组出现呕吐的患者比例分别为18.3%和19.5%,而安慰剂组这一数值为44.3%(p<0.0001)。
6.罗氏TIGIT单抗联合治疗肝癌早期临床积极。罗氏TIGIT单抗tiragolumab将在ASCO2023年会上公布其联合阿替利珠单抗+贝伐珠单抗一线治疗不可切除的局部晚期或转移性肝细胞癌(uHCC)患者的Ib/II期Morpheus-Liver临床积极结果。与阿替利珠单抗+贝伐珠单抗治疗相比,tiragolumab联合治疗显著提高患者的客观缓解率(ORR:42.5%vs11.1%)和无进展生存期(中位PFS:11.1个月vs4.2个月,HR:0.42(95% CI:0.22-0.82))。两组发生3/4级治疗相关不良反应的概率分别为27.5%和33.3%。
医药热点
1.“医生红黑榜”惊现三甲医院。近日,内蒙古医科大学附属医院启动医德医风建设专项行动,并在医院门口以电子屏滚动播放形式向公众展示“医德医风公示栏”,对涌现出的先进和负面典型给予公示。关于为何会上榜,内蒙古医科大学附属医院副院长刘海波表示,是“红榜”还是“黑榜”,理由就是患者满意或不满意,信息收集渠道包括投诉热线、信件、网站、政务热线等。
2.国内首个月经病管理分会成立。5月27日,北京妇产学会月经病管理分会正式成立,旨在推动京津冀地区妇科月经病规范化诊治,同时规范化培养妇产科专业化医师及技术人才,提高北京及周边地区领域妇科月经病管理水平,提高患者生活质量,最终提高妇女生殖健康水平。北京妇产学会月经病管理分会第一届委员会主任委员由北京大学人民医院妇科内分泌杨欣教授担任。
3.马斯克“脑机接口”公司获批启动首次人体临床。据外媒报道,马斯克的“脑机接口”技术公司Neuralink于25日宣布,FDA已批准他们启动首次人体临床研究。Neuralink公司成立于2016年,主要开发人脑与机器的接口,通过可植入人脑的设备,帮助人类与人工智能结合起来。马斯克表示,未来脑机接口技术能帮助解决人类身体带来的种种限制,例如能够帮助四肢瘫痪的人使用手机,甚至包括再次行走。
4.内脏过量脂肪或与痴呆相关。近日,《柳叶刀》子刊《The Lancet Regional Health - Western Pacific》在线发表了新加坡南洋理工大学Theresia Mina博士团队最新研究论文。该研究基于8000多名亚洲人群的数据分析发现,过度肥胖是认知功能下降的关键代谢风险因素。内脏过量脂肪每增加0.27kg,认知功能下降的程度相当于“衰老”了0.7岁。
评审动态
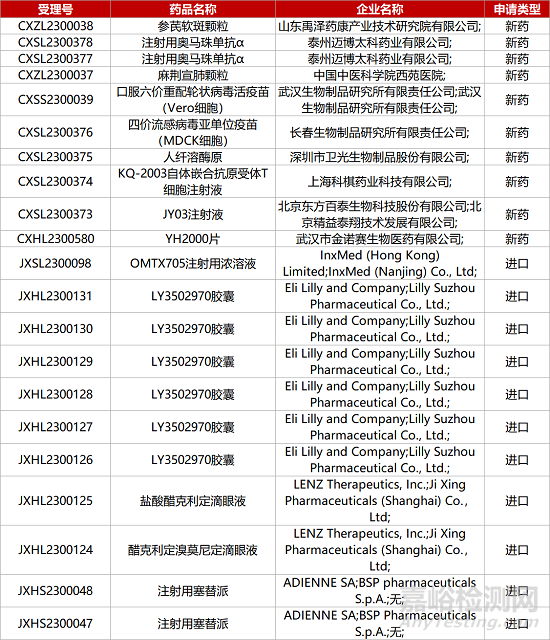
1. CDE新药受理情况(05月27日)
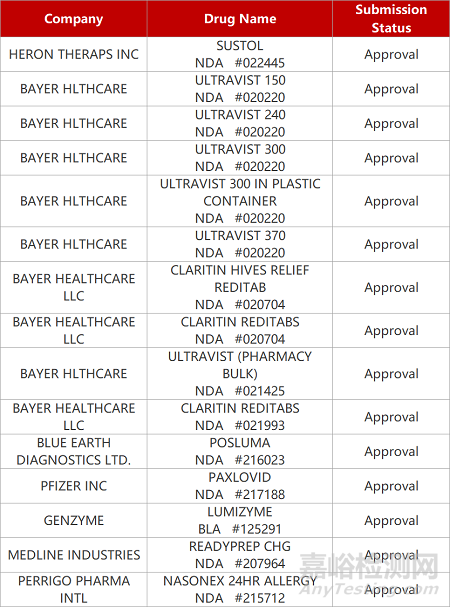
2. FDA新药获批情况(北美05月26日)