今日头条
苏州同宜双配体偶联药物获批临床。同宜医药1类化药注射用CBP-1019获国家药监局临床试验默示许可,拟用于治疗转移或复发的叶酸受体和TRPV6受体双表达的晚期恶性肿瘤患者,包括但不限于晚期肺癌,晚期胰腺癌,晚期食管癌,晚期结直肠癌和晚期子宫内膜癌等。CBP-1019是新一代双配体小分子药物偶联体,已于今年1月获得FDA临床批准。同宜医药计划在中、美开展CBP-1019用于治疗晚期恶性肿瘤患者的国际I/II期临床研究。
国内药讯
1.欧康维视过敏性结膜炎新药报产。欧康维视与Nicox公司联合开发的新型眼用制剂OT-1001(ZERVIATE,0.24%盐酸西替利嗪滴眼液)的新药上市申请获国家药监局受理。2022年3月,OT-1001在治疗过敏性结膜炎的中国Ⅲ期临床中获积极结果,与对照药相比,OT-1001治疗第14天访视前24小时内眼痒分数与基线相比变化达到非劣效性标准。在美国,该新药已获得FDA批准用于治疗过敏性结膜炎相关的眼痒。
2.瓴路CD19-ADC中国注册临床积极。瓴路药业与ADC Therapeutics共同合资的瓴路爱迪思开发的CD19-ADC药物Loncastuximab tesirine,在单药用于治疗复发/难治性弥漫大B细胞淋巴瘤(R/R DLBCL)的中国II期注册临床OL-ADCT-402-001达到主要研究终点,其有效性与安全性数据与全球关键临床试验ADCT-402-201结果一致。Loncastuximab tesirine是全球首个也是唯一个靶向CD19的ADC药物,已于2021年4月获FDA加速批准上市,用于治疗至少接受过2线及以上系统治疗的R/R DLBCL患者。
3.明慧JAK抑制剂皮炎Ⅱ期临床成功。明慧医药JAK抑制剂MH004乳膏治疗轻中度特应性皮炎的Ⅱ期临床达到主要终点和次要终点。在4周治疗后,1.0% MH004乳膏组和安慰剂组其湿疹面积及严重指数(EASI)评分的平均百分比变化分别为-78.7%和-46.7%(p=0.0003),两组达到EASI-75应答的患者比例分别为79.6%和42.0%(p<0.0001),研究者总体评估治疗成功(IGA-TS)反应的患者比例分别为46.9%和20.0%(p=0.0011);药物的安全性良好。
4.友芝友TGF-β/VEGF双抗获批临床。武汉友芝友生物VEGF/TGF-β双特异性抗体Y332获国家药监局临床默示许可,适应症为转移性或局部晚期实体瘤。Y332通过同时靶向VEGF和TGF-β,在协同效应下改变癌症患者的免疫抑制性TME,恢复患者失调的抗肿瘤免疫力。2022年8月,泽璟制药开发的抗VEGF/TGF-β双功能抗体融合蛋白ZGGS18已获得NMPA批准临床。
5.启德TROP2靶向ADC海外授权。启德医药宣布与Pyramid公司就其临床前期TROP2靶向抗体偶联药物(ADC)GQ1010签订独家许可协议,授予后者在除大中华区(中国大陆、香港、澳门和台湾地区)外全球范围内开发和商业化GQ1010权益。根据协议,启德医药将获得2000万美元预付款和高达10亿美元的里程碑后期付款,以及产品的销售分成。
国际药讯
1.AAD激越药物获FDA咨询委员会推荐。大冢制药和灵北合作开发的非典型抗精神病药物Rexulti(brexpiprazole)的新适应症上市申请获FDA咨询委员推荐批准,用于治疗阿尔茨海默病痴呆症(AAD)相关的激越。在Ⅲ期临床中,与安慰剂组相比,brexpiprazole治疗组12周后评估激越症状的CMAI评分和疾病严重程度CGI-S评分均具统计学显著性的改善。2022年,该药物为灵北赢得28.5亿丹麦克朗(4.05亿美元)的销售额。
2.诺和诺德新降糖组合启动III期研究。诺和诺德在clinicaltrials.gov网站上登记启动一项III期临床,评估每周1次胰岛素制剂Icodec联合长效GLP-1激动剂司美格鲁肽用于治疗2型糖尿病的效果。该项研究在捷克和泰国开展,拟纳入148例患者,预计将于2025年3月完成。目前,Icodec已完成多项针对2型糖尿病患者和1型糖尿病患者的头对头III期临床试验,预计今年上半年在美国、欧洲和中国提交上市申请。
3.麦角酸二乙酰胺重度抑郁Ⅱ期临床积极。Mind Medicine公司拟用于治疗重度抑郁症(MDD)的在研新药麦角酸二乙酰胺(lysergide)在Ⅱ期临床中达到主要终点。与安慰剂相比,lysergide首次给药后16周显著改善MDD症状,高剂量组患者的IDS-C(临床评定抑郁症状目录)评分从基线至最小二乘平均变化为-12.9分,而较低剂量组的患者为-3.6分(p=0.02)。此外,药物总体耐受性良好。
4.FDA拒绝批准礼来IL-23单抗上市。礼来IL-23p19单抗mirikizumab用于治疗中重度溃疡性结肠炎(UC)的BLA申请收到FDA的完整回复函(CRL)。FDA对该药物的临床数据、安全性以及标签并没有任何异议;主要是出于mirikizumab的拟生产制造过程中的存在一些疑问担忧。Mirikizumab旨在通过与IL-23的p19亚基结合以阻断IL-23介导的炎症反应。目前该新药用于克罗恩病适应症研究已进入III期临床。
5.“3分钟控汗贴片” 获FDA批准上市。FDA批准Candesant Biomedical公司创新医疗设备“3分钟控汗贴片”Brella上市,用于减少原发性腋窝多汗症成人的腋下过度出汗。Brella控汗贴片由钠片和粘合剂覆盖层组成,是一种一次性使用贴片。Candesant公司专注于多汗症或过度出汗的非侵入性治疗的开发和商业化,除Brella控汗贴片,该公司还在探索治疗面部多汗症、手掌多汗症、足底多汗症等。
6.武田近4亿美元布局Tau蛋白小分子药。武田与Treventis Corporation公司将利用后者专有的共同构象形态(CCM)技术平台,合作开发针对阿尔茨海默病(AD)关键蛋白Tau的小分子药物。CCM能够识别错误折叠的蛋白质靶点中的药物活性位点。根据协议,武田将获得全球范围内开发和商业化该Tau项目的独家许可权;Treventis公司将获得研究资金、预付款、临床和商业里程碑后期付款,最高可达3.725亿美元。
医药热点
1.浙江省儿童保健联盟正式成立。4月13日,浙江省儿童保健联盟在杭州正式成立。该联盟由国家儿童健康与疾病临床医学研究中心、国家儿童区域医疗中心、浙江大学医学院附属儿童医院、浙江省儿童保健质量管理质控中心牵头成立,将开展儿童保健专业规划化培训和资格认证,建立儿童保健服务与临床相结合的分级管理体系建设,创建省-市-县-乡镇四级儿童保健科研协同网络。首批共有60家单位参加联盟,包括11家地市级妇幼保健院、40家县级妇幼保健机构、9家基层卫生服务机构。
2.复旦儿科医院调整党政主要负责人。4月10日上午,复旦大学附属儿科医院召开干部大会,宣布复旦大学党委关于医院党委书记和院长的任命决定。李倩同志担任复旦大学附属儿科医院党委书记,王艺同志担任复旦大学附属儿科医院党委副书记、院长。徐虹同志因年龄原因不再担任党委书记职务,黄国英同志因年龄原因不再担任党委副书记、院长职务。
3.国家卫健委:严控公立医院无序扩张。13日,国家卫健委就优质医疗资源扩容下沉和区域均衡布局有关情况举行发布会,国家卫健委医政司副司长李大川表示,公立医院发展“一院多区”,应合理控制分院区的数量,避免重复建设和资源浪费。根据《医疗机构设置规划指导原则(2021-2025年)》,到2025年末,符合条件的公立医院举办分院区不得超过3个;新增分院区的,每个分院区的床位数量不低于二级同类别医院最低要求,各分院区总床位数不超过2020年末主院区编制床位数的80%。
4.湖南对各类核酸检测实行技耗分离,收费25元。湖南省医保局发布《关于对部分医疗服务价格项目公开征求意见的公示》,其中对于项目编码250503015的各类核酸检测实行技耗分离收费,除试剂盒外,一类收费25元,同时检测多位点,每位点加收20%。定性检测费用每位点合计不超过50元。定量分析加收200%,每位点合计不超过150元。目录内已有收费项目不得按此项目收费。
评审动态
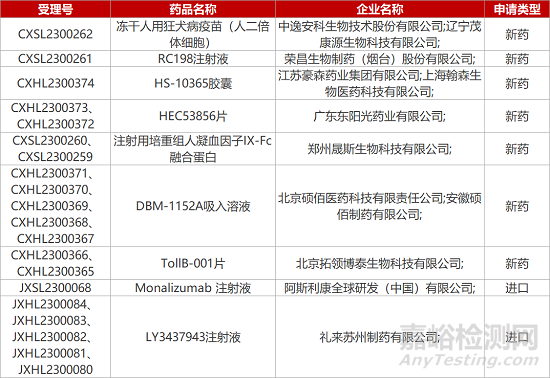
1. CDE新药受理情况(04月16日)
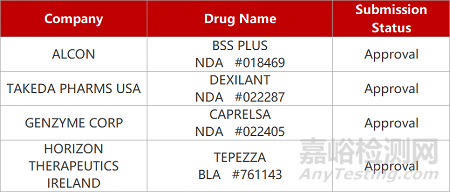
2. FDA新药获批情况(北美04月14日)