摘要
我国现行的药品上市后变更管理思路借鉴了欧美上市后变更管理制度,本研究首先介绍美国、欧盟及中国的变更管理制度,然后重点对我国近期发布实施的《已上市化学药品药学变更研究技术指导原则(试行)》进行介绍,以助于更好地理解和使用该变更指导原则。
背景
药品上市后变更管理是药品全生命周期管理的重要组成部分。《药品上市后变更管理办法 ( 试行 )》(以下简称《办法》) 是我国首部专门针对药品上市后变更设置的规范性文件,其实施目的和意义主要体现在以下两方面 :一方面鼓励药品上市许可持有人 (marketing authorization holder,MAH) 运用新生产技术、新方法、新设备、新科技成果,不断改进和优化生产工艺,持续提高药品质量,提升药品安全性、有效性和质量可控性 ;另一方面,坚决贯彻习近平总书记对于药品监管工作“四个最严”的要求,规范药品变更行为和变更监管,严厉打击非法变更,落实MAH 主体责任,保障人民群众用药安全。
我国的药品上市后变更管理主要参考美国 FDA和欧盟 EMA 等先进管理理念制修订。本研究首先介绍美国 FDA 和欧盟 EMA 的药品上市后变更管理制度,然后介绍我国现行的变更管理制度,最后对我国新发布实施的《已上市化学药品药学变更研究技术指导原则 ( 试行 )》( 以下简称“新版变更指导原则”) 进行简要介绍,以助于更好地理解和执行。
一、美国药品上市后变更管理简介
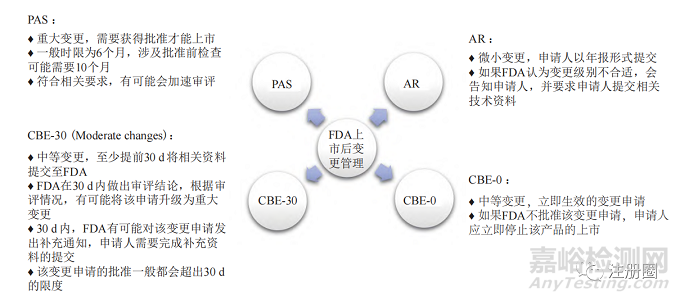
美国 FDA 依据变更对产品质量产生影响的可能性,将已上市产品的变更分为批准前补充申请 (prior approval supplement,PAS)、30 d 后执行(changes being effffected in 30 days,CBE-30)、立即生效 (changes being effected,CBE-0) 和年度报告(annual report,AR)4 种情形。其变更管理概况见图1。
▲ 图1-美国 FDA 上市后变更管理概况
Fig.1 Overview of Post-approval Change Management of FDA
很难在一个变更指导原则中囊括所有的变更事项,FDA 针对变更发布了多个指南文件 [1—5],针对不同剂型发布的变更指导原则包括速释口服固体制剂、缓释口服固体制剂及非无菌半固体制剂的扩大规模和上市后变更等。
二、欧盟 EMA 上市后变更管理简介
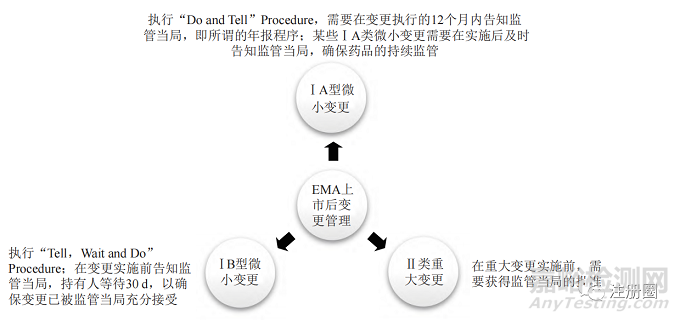
欧盟 EMA 的上市后变更管理程序与 FDA 基本相似,依据变更对产品质量产生影响的可能性将变更分类划分为Ⅰ A、Ⅰ B 和Ⅱ类变更。欧盟上市后变更管理程序简介见图2。
▲ 图2-欧盟 EMA 上市后变更程序简介
Fig.2 Post-approval Change Management Protocols of EMA
欧盟上市后变更指导原则除了规定上述ⅠA、ⅠB 和Ⅱ类变更外,还规定了扩展 ( extensions)和紧急安全性限制 (urgent safety restrictions) 等内容 [6]。前者包括规格变更、剂型变更或给药途径变更等 ;后者指申请人或监管机构对威胁公众健康的事件采取的即刻变更程序,紧急安全限制可以在发起后15d 内提交正式变更申请。
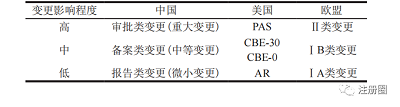
在药品上市后变更管理方面,中国充分借鉴了欧美上市后变更管理思路,引入了依风险进行变更管理的理念,同时体现了与国际接轨的监管思路。中美欧对药品上市后变更均是按照变更的程度和风险等级划分管理要求,即根据变更对药品安全性、有效性或质量可控性产生影响的可能性设定不同的变更等级,并分别设立了相应的递交途径、审批时限和变更实施原则。详见表 1。
▲ 表1-中美欧变更管理情况对比
Tab.1 Comparison of Change Managements
between China, the United States and Europe
我国将变更级别分为重大变更、中等变更、微小变更。需要强调的是,重大变更不一定会对产品质量产生实质性影响,之所以将某些变更事项划分为重大变更,是因为该变更对产品质量、安全性及有效性等产生影响的可能性比较大,而微小变更对产品质量、安全性及有效性产生影响的可能性比较小。
四、“新版变更指导原则”简介
在对新旧两版“已上市化学药品变更指导原则”进行对比的基础上,本研究对新版变更指导原则进行简要介绍,希望更好地促进该指导原则的贯彻执行。
4.1 新旧两版“已上市化学药品变更指导原则”对比
随着新的《药品注册管理办法》落地实施,之前的变更管理思路已不再符合现行的法规技术要求。为了与新法规配套,国家药品监督管理局药品审评中心 (CDE) 组织修订了“新版变更指导原则”,并正式发布实施。为更好地理解新版变更指导原则,现对新旧两版上市后变更指导原则进行简单对比,以突出修订重点,便于理解和执行。详见表 2。
▲ 表2-新旧两版已上市化学药品变更研究的技术指导原则对比
Tab.2 Comparison of Technical Guidelines for Change Research of Listed Chemical Drugs between the Old and New Editions
部分变更分类与原来的法规指南相比有了较大改变。比如,药品分包装由审批改为备案,很大程度上简化了流程、缩短了时限 ;再比如,审批类变更纳入“持有人转让药品上市许可”,这意味着MAH 的变更被视为重大变更,MAH 的资质将在药品上市许可转让过程中被重点考察 ;新的变更管理制度增加了报告类的变更途径,企业可采用年度报告的方式报告微小变更 ( 实际生产过程中,发生微小变更的频次是最高的,重大变更发生的频次较少 ),无需审评审批,提升了 MAH 实施变更的及时性和自由度。
4.2 新版变更指导原则的相关章节介绍
4.2.1 变更生产场地
MAH 制度下,与以前最大的变化是生产场地发生变更,所以法规单独拿出来,分别对 MAH 变更和生产场地变更制定了管理要求,此部分内容详见《办法》和《药品生产监督管理办法》。
仅发生 MAH 变更,受让方应取得相应生产范围的药品生产许可证,并向 CDE 提出补充申请,此外变更后的 MAH 也需要进行 GMP 符合性检查,确保变更后的 MAH 能够履行责任,并能够持续稳定地生产出符合质量要求的产品。
生产场地变更,包括生产地址的改变或新增,或同一生产地址内的生产场地的新建、改建、扩建。关于生产场地变更,新版变更指导原则中没有按照其他注册事项变更进行微小、中等及重大变更情况的描述,而是指出“生产场地变更需要按照《药品生产监督管理办法》及《药品上市后变更管理办法( 试行 )》相关规定执行”。生产场地变更一般由监管经验比较丰富的省局进行管理。
2008 年的变更指导原则中,国产药无变更生产场地的相关规定,原因是之前的药品批准文号直接与生产企业关联,如果生产企业发生变更,只能走技术转移的申报路径,先将自己的批准文号注销才能完成产品从一个生产企业转移至另外一个生产企业。因 MAH 制度的实施,药品批准文号不再直接与生产企业关联,而是隶属于 MAH,所以新版变更指导原则增设变更生产场地的相关规定。新版变更指导原则虽未对生产场地变更进行变更等级划分,但对生产场地变更的研究验证工作进行了规定,MAH/ 生产企业在申报原料药或制剂的生产场地变更时可以参考进行研究验证工作。
4.2.2 变更制剂处方中的辅料
制剂处方中的辅料变更情形主要包括变更辅料的种类、用量、技术等级、供应商、质量标准等,新版变更指导原则细化了普通口服固体制剂、口服缓释 / 控释制剂、肠溶制剂及非无菌半固体制剂这3 大类剂型的变更情况及验证研究工作。指导原则中未涵盖的剂型一般比较复杂或是辅料变更风险比较高,故对指导原则中未涵盖剂型的辅料用量变更按照重大变更进行严格管理。由于辅料对治疗窗窄及生物药剂学分类系统 (BCS) Ⅳ类的药物影响较显著,故当窄窗药物及 BCS Ⅳ类药物的辅料用量变化超出微小变更范围时,均应按照重大变更进行研究。
与旧版变更指导原则相比,新版变更指导原则的变化较大之处在于将非无菌半固体制剂中防腐剂用量变更单独进行规定。具体允许的防腐剂变更幅度分别规定为 :微小变更——变更不超过原批准用量的 10% ;中等变更——变更大于原批准用量的10%、不超过 20% ;重大变更——变更超过原批准用量的20% (包括删除防腐剂 )或变更防腐剂种类。变更防腐剂应提交的研究验证工作与其他变更情况相比有一个不同之处,即不管变更分类是微小变更还是重大变更,都应提供规定范围内抑菌剂最低浓度的抑菌效力试验,以证明变更后产品的微生物限度符合要求。
由于不同剂型的不同变更类别涵盖的变更事项在指导原则中描述得较为详细,故本研究不再赘述。
4.2.3 变更生产批量
变更生产批量为新版变更指导原则中的新增章节,包括原料药批量和制剂批量变更。原料药的批量变更只有微小和中等两个变更分类,制剂的批量变更依风险分为微小、中等和重大变更。
不同的剂型或不同的制备工艺,其批量变更风险不同,制剂批量变更中的重大变更一般为特殊剂型制剂 ( 如复杂工艺的缓控释制剂及肠溶制剂、透皮给药制剂、脂质体、长效制剂等 ) 的生产批量变更。这里需要关注的是缓控释制剂及肠溶制剂的修饰词“复杂工艺”,例如工艺较为简单的骨架型缓释片,其批量变更对其质量产生影响的可能比较小,此时可以降低其变更分类。
批量变更往往伴随着生产设备和 ( 或 ) 工艺参数的变更,所以批量变更的所有变更分类,不论是重大变更还是微小变更均需进行工艺验证,提供批生产记录,并进行质量对比研究,对样品批次的要求也有所增加。
4.2.4 变更制剂所用原料药的供应商
变更制剂所用原料药的供应商不应对药品安全性、有效性和质量可控性产生负面影响。旧版变更指导原则将原料药变更划分为进口和国产,分别进行变更情况的描述,而新版变更指导原则不再区分进口和国产产品,统一要求。
变更制剂所用原料药的供应商一般按照中等变更进行管理,变更后的原料药如尚未获得批准,则按照重大变更管理。不管是中等变更还是重大变更均需要进行较为详细的研究验证工作,以证明变更制剂所用原料药的供应商不会对药品安全性、有效性和质量可控性产生负面影响。
4.2.5 变更注册标准、有效期和贮存条件
变更药品注册标准的适用范围一般包括变更原料药及制剂注册标准中的检验项目、检验方法、限度等。注册标准是反映和控制药品质量的重要手段,与上市后药品抽检及其质量保障密切相关,为方便上市后监管,将注册标准变更风险等级划分为中等和重大,没有微小变更的分类。
药品有效期和贮存条件变更可能包含以下几种情况 :①延长或缩短有效期 ;②严格或放宽贮存条件。变更可能只涉及上述某一种情况的变更,也可能涉及上述多种情况的变更。一般情况下,有效期的变更为中等变更,而贮存条件变更均为重大变更,若贮存条件发生变更,应提供充分的变更研究资料。
4.2.6 变更原料药和制剂生产工艺
变更原料药生产工艺主要指化学合成原料药生产工艺或半合成原料药的化学合成及之后生产工艺的变更,主要包括合成路线、生产条件、物料控制 / 过程控制及其他可能的变更。此部分内容充分体现了与国际接轨的监管思路,其先进性及科学性主要体现在以下两方面 :①变更合成路线的,变更后合成路线中起始物料的选择应符合人用药品技术要求国际协调理事会 (ICH)Q11 的相关要求 ;②在对比研究中,杂质谱一致的认定条件体现了与 ICHQ3A、ICH Q3C、ICH Q3D 及 ICH M7 的接轨。
通过风险评估来确定原料药的变更分类,非无菌原料药的变更分类依据变更对原料药杂质谱以及关键质量属性产生影响的程度来划分,而无菌原料药还需要评估变更对其无菌保障水平产生的影响。风险评估中,变更越靠近成品,风险越高 ;变更合成路线,或合成工艺中使用新的试剂 / 溶剂,其杂质谱产生变化的风险较高。按照确定的变更分类提供相应的研究验证资料。
制剂生产工艺变更主要包括变更制剂生产过程及工艺参数、变更原料药内控标准 / 制剂中间体内控标准或生产过程控制、变更制剂生产设备、变更制剂的外形等。以变更制剂外形为例,其变更风险依据变更对制剂的影响程度以及制剂剂型和制剂生产工艺的复杂程度等确定。普通口服片剂、胶囊剂或栓剂形状、尺寸的微小变化归类为微小变更,而发生显著变化的为中等变更,但不管是形状、尺寸的微小变更还是中等变更,变更前后的溶出行为均不能发生改变 ;变更缓控释制剂的形状、尺寸和刻印或者增加 ( 或删除 ) 片剂的功能性刻痕均为重大变更,对产品关键质量属性产生影响的风险较大,需提供充分的研究验证工作。
制剂生产工艺变更情形复杂,变更指导原则不能涵盖可能的所有变更情形,MAH 应当根据内部变更分类原则、工作程序和风险管理标准,结合产品特点,参考有关技术指导原则,在充分研究、评估和必要验证的基础上确定变更管理类别。
4.2.7 变更包装材料和容器
包装材料和容器是药品的组成部分,主要指直接接触药品的包装材料和容器。包装材料和容器的变更包括改变、增加或去除的情形,以上变更情形可能对药品的理化性质、杂质谱、含量、稳定性、无菌保障水平等产生影响。包装材料和容器的变更依风险分为微小、中等和重大变更,此部分变更应重点关注高风险制剂 ( 比如眼用制剂或注射剂 ) 的包材变更,同时还应关注全新材料、全新结构、风险度提高的新用途的包装材料和容器的使用,对产品质量产生风险的可能性较高。
对于重大变更的研究验证工作可能需要进行包材相容性研究,对于密封件的变更还需开展包装密封性研究等。
4.2.8 新增规格
新增规格均按重大变更管理。
新版变更指导原则和《已上市化学药品和生物制品临床变更技术指导原则》中均有规格变更的相关规定,这 2 个变更指导原则中规定的规格变更有本质不同。
药学变更中增加规格,是指新增规格应为原研药品增加的新规格,或仿制药增加目前原研药品 /参比制剂已有的规格,同时不得改变药品原批准的适应证、用法用量或适用人群等。变更分类为重大变更,同时需参照现行的相关技术指导原则,考虑新增规格是否需要进行生物等效性研究。
临床变更中增加规格,是指新增规格的药物含量未在已批准说明书的用法用量范围内,增加新规格通常在用法用量变更的同时提出。此类变更为重大 A 类变更,因新增规格与尚未批准的用法用量密切相关,需要临床试验数据的支持。故此类变更一般需要提出 2 次申请,申请人应首先提出开展支持新增规格和用法用量变更的临床试验申请以获得临床试验批件,待临床试验完成,获得充分支持性证据后,再次提出相应的变更申请。
此外,新增规格还包括多剂量包装变更为单剂量包装,比如多剂量的滴眼液变更为处方中去除防腐剂的单剂量包装等,也属于重大变更,需进行较为详细的研究验证工作。
4.2.9 关联变更
药品某一项变更往往不是独立发生的。例如,批量变更往往同时伴随生产设备及生产工艺的变更,处方变更可能伴随或引发药品注册标准的变更,增加规格可能会调整处方等。我们将一项变更伴随或引发的其他变更称之为关联变更。
对于关联变更,研究工作可按照新版变更指导原则中各项变更研究工作的基本思路分别进行,也可综合考虑各项变更研究工作的要求而一并进行。由于这些变更对药品安全性、有效性和质量可控性产生的影响程度可能不同,即这些变更可能归属于新版变更指导原则中各项变更的不同类别,在按照不同类别变更相应技术要求开展研究工作时,研究工作总体上应按照技术要求较高的变更类别进行,同时建议关注多项关联变更对药品安全性、有效性和质量可控性产生的叠加影响。
五、结语
目前,我国的变更管理理念主要参考了美国FDA 及欧盟 EMA 的变更管理制度,引入了依风险进行变更管理的思路,体现了逐渐与国际接轨的监管理念,使我国的上市后变更管理更加科学。本研究对 FDA 和 EMA 的变更管理制度进行简单介绍,然后引入我国现行的变更管理制度,最后对我国近期发布实施的新版变更指导原则进行介绍,促进该指导原则的正确理解和执行。鼓励 MAH 在对产品及其工艺、质量控制等不断深入理解的基础上,采用 ICH 指导原则 ( 如 ICHQ12 等 ) 中的各种变更管理工具,对变更进行研究和分类,这将有利于主动对已上市药品进行持续改进和创新。新版变更指导原则也将会在使用中不断更新和完善。
参考文献
[1] FDA.Changes to an approved NDA or ANDA: guidance for industry [EB/OL].(2004-08-04)[2021-09-13].https://www.fda.gov/media/71846/download.
[2] FDA.SUPAC-IR: immediate-release solid oral dosage forms: scale-up and post-approval changes: chemistry,manufacturing and controls, in vitro dissolution testing, and in vivo bioequivalence documentation [EB/OL].(1995-11-01)[2021-09-13].https://www.fda.gov/media/70949/download.
[3] FDA.SUPAC-IR questions and answers about SUPACIR guidance [EB/OL].(1997-02-18)[2021-09-13].
https://www.fda.gov/regulatory-information/search-fdaguidance-documents.
[4] FDA.SUPAC-MR: modified release solid oral dosageforms scale-up and postapproval changes: chemistry,manufacturing, and controls; in vitro dissolution testing and in vivo bioequivalence documentation: guidance for industry [EB/OL].(1997-10-06)[2021-09-13].https://www.fda.gov/media/70956/download.
[5] FDA.SUPAC-SS: nonsterile semisolid dosage forms; scaleup and post-approval changes: chemistry, manufacturing and controls; in vitro release testing and in vivo bioequivalence documentation: guidance for industry [EB/OL].(1997-05-01)[2021-09-13].https://www.fda.gov/media/71141/download.
[6] EMA.Guidelines on the details of the various categories of variations [EB/OL].(2013-08-02)[2021-09-13].https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:C: 2013:223:FULL:EN:PDF.
[7] 国家药品监督管理局.已上市化学药品变更研究的技术指导原则(一)(国食药监注[2008]242号)[EB/OL].[2021-09-13].https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20080515120001217.html.