今日头条
东诚抗肿瘤放射性药物获批临床。东诚药业旗下新加坡子公司开发的靶向FAP的放射性体内治疗药物177Lu-LNC1004注射液获FDA批准开展Ⅰ期临床试验。LNC1004前体能特异性地与CAF膜表面的FAP结合,通过将放射性核素177Lu靶向运送至FAP阳性表达的实体瘤,实现肿瘤的精准治疗。临床前研究显示,177Lu-LNC1004能杀伤胃癌、食管癌、肺癌、甲状腺癌等实体肿瘤细胞,具有治疗潜力。
国内药讯
1.迪哲EGFR-TKI肺癌适应症报产。迪哲医药EGFR-TKI创新药舒沃替尼片上市申请获国家药监局受理,拟用于既往经含铂治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。公布于ESMO2022年会上的注册研究(WU-KONG6)数据显示,该新药经确认的ORR为59.8%;基线伴有脑转移患者经确认的ORR为48.4%。
2.礼来长效降糖药新适应症在华报产。礼来每周给药一次的长效GLP-1受体激动剂度拉糖肽的新适应症上市申请获CDE受理,联合胰岛素治疗成人2型糖尿病。Ⅲ期临床(AWARD-CHN3)28周数据显示,度拉糖肽联合滴定的甘精胰岛素可显著降低2型糖尿病患者的糖化血红蛋白(HbA1c)、体重及空腹血清葡萄糖,达到主要终点和所有关键次要终点。
3.长效甲旁减激素替代疗法Ⅲ期临床积极。维昇药业从Ascendis公司引进的每日一次的甲状旁腺激素前药帕罗培特立帕肽在治疗甲状旁腺功能减退症的中国Ⅲ期临床(PaTHway China)完成双盲治疗期,即将进行主要终点分析。主要疗效终点为评估接受帕罗培特立帕肽治疗的甲旁减患者在停用常规钙和活性维生素D治疗时血清钙在正常范围(8.3-10.6 mg/dL)的有效性。该药物已获FDA授予优先审评资格,预计4月30日完成审查。
4.道明TTK抑制剂获FDA快速通道资格。道明生物苏氨酸酪氨酸激酶(TTK)抑制剂CFI-402257获FDA授予快速通道资格,用于治疗先前使用CDK4/6抑制剂及内分泌治疗后疾病进展的ER阳性/HER2阴性乳腺癌晚期的成年患者,可作为单一疗法,亦可与氟维司群联合治疗。ER阳性/HER2阴性乳腺癌亚型是乳腺癌最常见的亚型,占所有乳腺癌类型的68%。CFI-402257有望为这类患者提供新的治疗方案。
5.天演CTLA-4安全抗体早期临床积极。天演药业CTLA-4安全抗体ADG126联合PD-1疗法治疗晚期/转移性实体瘤患者的Ⅰb/Ⅱ期临床中期数据积极。天演药业的安全抗体SAFEbody技术可最大限度地减轻由于靶向在健康组织中表达的靶点而诱发的毒副作用,从而解决众多抗体疗法面临的安全性与耐受性挑战。联用治疗显示出良好的安全性与初步疗效。天演药业计划在2023年上半年的医学会议上公布这项试验的剂量递增数据。
6.BT-001靶向CAR-T上Ⅰ期临床。Bio4t2公司基于其专有PrismCore™平台开发的BT-001靶向CAR-T疗法完成治疗实体肿瘤患者的Ⅰ期临床(NCT05621486)首例受试者给药。BT-001在多种类型的实体肿瘤中过度表达。该项研究在上海市东方医院和上海阿特蒙医院进行,评估自体CAR-T经过清淋治疗后作为单剂在成人受试者体内的安全性、耐受性、药代动力学、药效动力学和初步疗效。
7.信诺维创新ADC产品海外授权。信诺维宣布与AmMax Bio公司达成合作许可协议,授予后者一款用于实体瘤治疗的创新性抗体偶联药物(ADC)除大中华区外的全球研发和商业化的独家转让权益。根据协议,信诺维将获得最高达8.71亿美元的支付款(包含首付款和开发、注册及销售里程碑)。双方将协作完成合作项目的临床试验申请(IND)以及剂量递增临床研究的设计,预计于2023中期递交中国和美国IND申请。
8.贺建奎拟开发杜氏肌营养不良(DMD)药物。贺建奎在其个人微博上宣布,将与蓝田教授及云舟生物团队合作,开发杜氏肌营养不良(DMD)的药物。贺建奎计划在2-3年内,攻克3-5种罕见病。其中DMD药物将是其第一个目标。他计划在2025年开展DMD人体临床试验,总预算为5000万。去年11月,贺建奎曾在其个人微博上透露,将在北京大兴建立贺建奎实验室,注册一家民办非盈利科学研究机构——北京罕见病研究所。
国际药讯
1.武田RNAi疗法特定肝病Ⅱ期临床成功。武田与Arrowhead公司开发的第二代皮下给药RNAi疗法fazirsiran(TAK-999/ARO-AAT),在治疗α-1抗胰蛋白酶缺乏相关的肝脏疾病(AATD-LD)的II期SEQUOIA研究结果积极。fazirsiran旨在抑制肝脏内突变的α-1抗胰蛋白酶(Z-AAT)产生,促进肝脏再生和修复。48周治疗数据显示,fazirsiran(25mg、100mg及200mg)将患者血清Z-AAT浓度平均降低74%、89%和94%,肝脏Z-AAT水平从5.9降低到2.3;而安慰剂组患者血清Z-AAT水平没有显著变化;肝脏Z-AAT水平增加26%。
2.FDA暂缓批准「伏诺拉生」新适应症。Phathom公司钾离子竞争性酸阻滞剂(P-CAB)伏诺拉生(vonoprazan,VPZ)用于治疗糜烂性食管炎(EE)新适应症遭到FDA暂缓批准。去年8月,Phathom宣布在商业批次中检测到微量的亚硝胺杂质N-亚硝基-伏诺拉生(NVP),并正在与FDA合作,以获得拟议的可接受每日摄入量限值。目前FDA已将NVP的可接受每日摄入量限制定为96 ng/天,但要求Phathom提供额外的稳定性数据。
3.胃肠道促动力剂新适应症报IND。Renexxion公司新型小分子泛胃肠道促动力剂naronapride向FDA递交新药临床试验申请,拟开发用于治疗囊性纤维化(CF)患者的胃肠道运动障碍。naronapride已在上、下胃肠道适应症的II期临床中取得积极结果,药物总体耐受性良好,未观察到naronapride对心血管的影响。目前,naronapride正在III期临床中评估治疗慢性特发性便秘(CIC)和胃食管反流病(GERD)的潜力。
4.基因编辑公司Metagenomi完成2.75亿美元融资。基因药物公司Metagenomi宣布完成B轮扩展融资,增加额外的1亿美元,使其B轮融资总额达到了2.75亿美元。Metagenomi公司致力于通过应用机器学习挖掘微生物基因组,从中寻找能够用于基因编辑的新的核酸酶。这种核酸酶在基因编辑效率方面是优于现有的CRISPR-Cas9基因编辑系统,编辑效率超过90%。目前该公司已发现了成百上千个潜在的核酸酶。
5.再生元阿柏西普2022年Q4销售不佳。再生元在摩根大通医疗保健会议上宣布眼科明星产品阿柏西普(Eylea)2022年第四季度的销售额为15亿美元,低于原先分析师预期的16.3亿~16.5亿美元。当天再生元股价下跌7.69%。再生元将该产品销售额未达预期归因于竞品竞争(罗氏的Avastin,贝伐珠单抗,适应症原为转移性结直肠癌,但获得了短期用于年龄相关性黄斑变性的许可)和患者共同支付基金暂停两个原因。
医药热点
1.华中科技大学附属协和医院重庆医院开工。中科技大学同济医学院附属协和医院重庆医院国家区域医疗中心建设项目暨两江新区社会民生项目集中开工活动10日在当地举行,19个社会民生项目总投资约106亿元。其中,华中科技大学同济医学院附属协和医院重庆医院,由重庆市人民政府与华中科技大学同济医学院附属协和医院共同建设。该医院总投资45亿元,占地面积210亩,总建筑规模38万平方米。一期项目建成后将提供1500张床位。
2.默沙东新冠口服药定价1500元。1月10日晚间,天津市医药采购中心发布消息称,默沙东新冠口服药莫诺拉韦胶囊(商品名:利卓瑞)已于天津市医药采购中心挂网,首发报价1500元/瓶,低于海外主要国家价格。据莫诺拉韦胶囊首发报价信息,其为胶囊剂,规格0.2g,包装40粒/瓶,进口到岸价 (不含税)介于1100元和1200元之间。莫诺拉韦胶囊主要国家价格为712美元,按现在汇率换算约合4826.65元。
评审动态
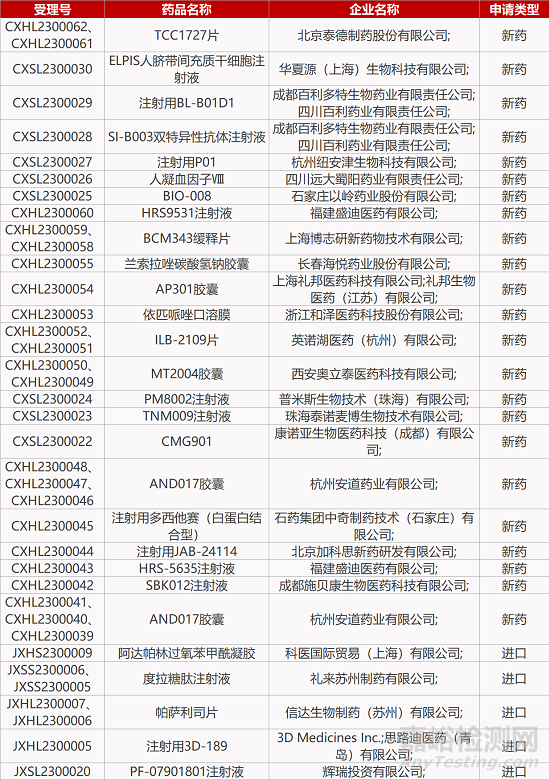
1. CDE新药受理情况(01月11日)
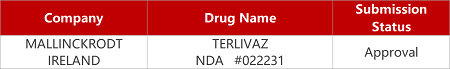
2. FDA新药获批情况(北美01月10日)