您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-12 05:07
1997年美国食品药物管理局现代化法案:标准清单的更新
美国食品药物管理局发布了一份公告,包含该机构正在对认可的用于上市前审查的标准(即FDA 认可的共识标准)进行的修改。本公告名为《对公认标准清单的修改,认可清单编号:057》,将帮助制造商选择声明符合共识标准以满足医疗器械特殊要求。
1997 年食品和药物管理局现代化法案(Pub. L. 105-115)第 204 节修订了联邦食品、药品和化妆品法案(FD&C 法案)第 514 节(21 U.S.C. 360d)。 修订后的FD&C 法案514 节允许 FDA 认可用于满足部分器械上市前审查提交或其他要求的,且由国际组织制定的共识标准。
Pub. L. 105-115:
https://www.govinfo.gov/content/pkg/PLAW-105publ115/pdf/PLAW-105publ115.pdf
21 U.S.C. 360d:
https://www.govinfo.gov/content/pkg/USCODE-2020-title21/pdf/USCODE-2020-title21-chap9-subchapV-partA-sec360d.pdf
FDA认可标准清单的变更
认可清单编号:057
FDA宣布增加、撤销、更正和修订其认可的某些共识标准,以用于上市前提交和其他设备要求。FDA正在将这些变更纳入该机构数据库的共识标准清单中。FDA 使用术语“认可清单编号:057”来标识当前的修改。
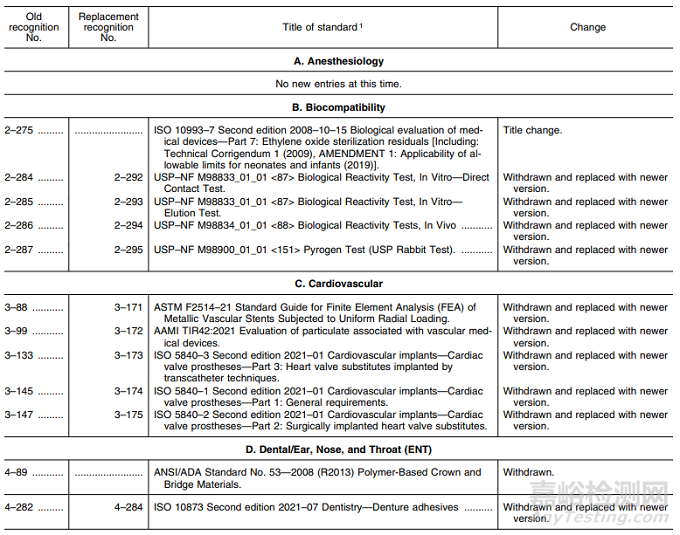
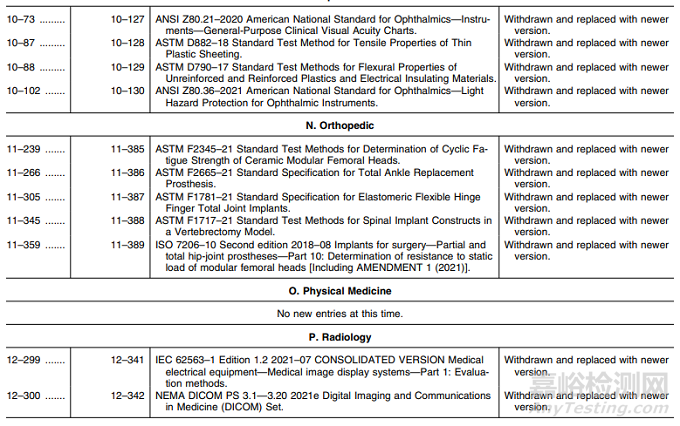
在表1中,FDA 描述了以下修改:(1) 标准的撤销和其他标准的替代(如适用);(2) 更正 FDA在列出先前认可的标准时的错误;(3)公认标准的补充信息表变化。
本次认可标准清单的修改涵盖:
B. 生物相容性:名称变更1项,新版标准替换5项;
C. 心血管:新版标准替换5项;
D. 牙科/耳鼻喉科:撤回标准1项,新版标准替换1项;
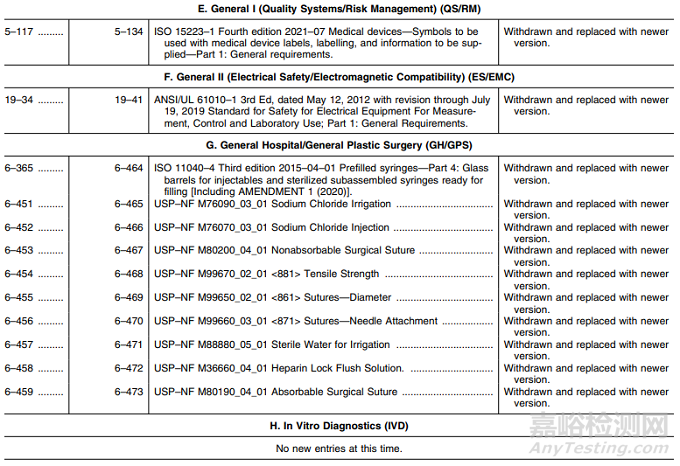
E. 一般I(质量体系/风险管理):新版标准替换1项;
F. 一般II(电气安全/电磁兼容):新版标准替换1项;
G. 综合医院/综合整形外科:新版标准替换10项;
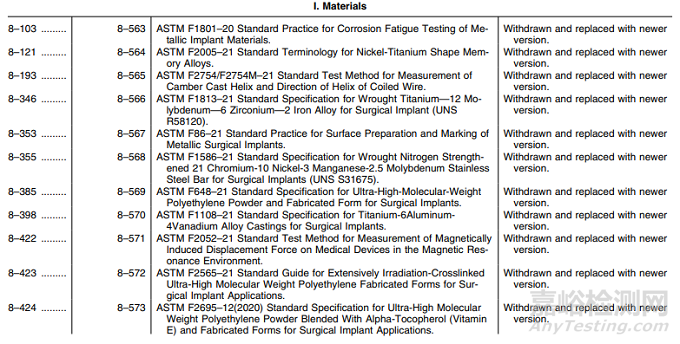
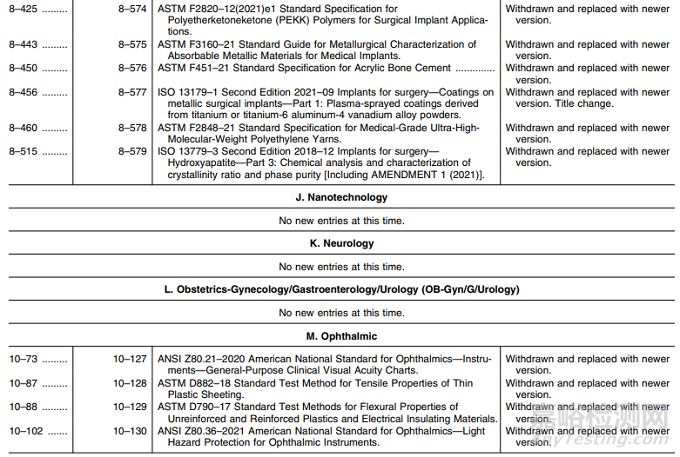
I. 材料:新版标准替换17项,其中名称变更1项;
M. 眼科:新标准替换4项;
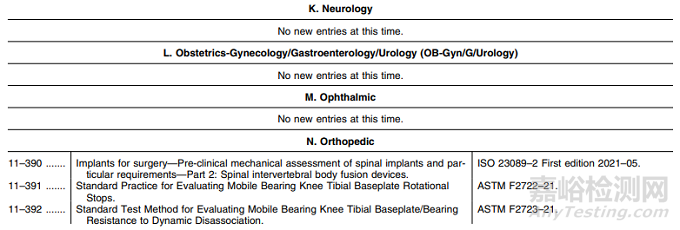
N. 矫形外科:新版标准替换5项;
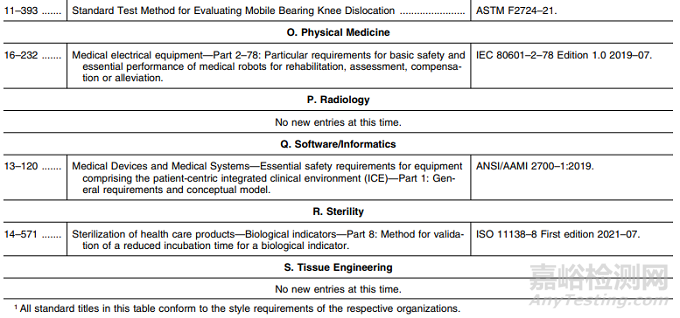
P. 放射科:新版标准替换2项;
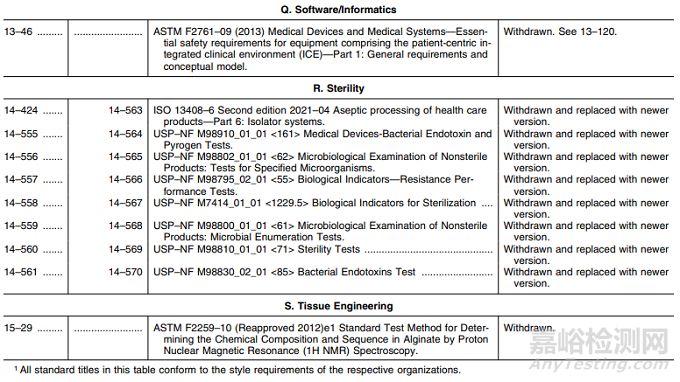
Q. 软件/信息:撤回标准1项;
R. 无菌:新版标准替换8项;
S. 组织工程:撤回标准1项。
变更涉及以上13个领域,63项标准。
详细信息如下:
表1——认可标准清单的修改
新增条目清单
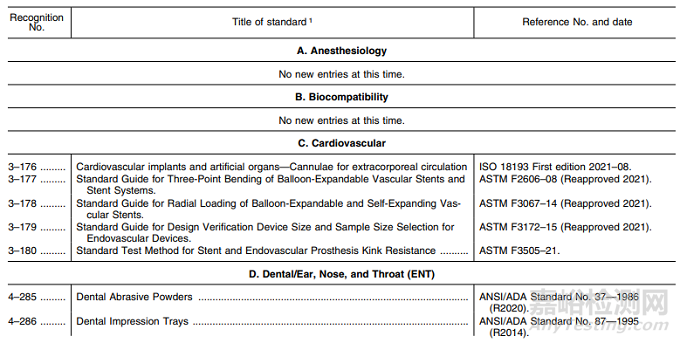
在表2中,FDA 提供了新条目和共识标准的清单,作为对认可清单编号:057 认可标准清单的修改添加。这些条目是 FDA之前未认可的标准。
本次认可标准清单的新增涵盖:
C. 心血管:新增标准5项;
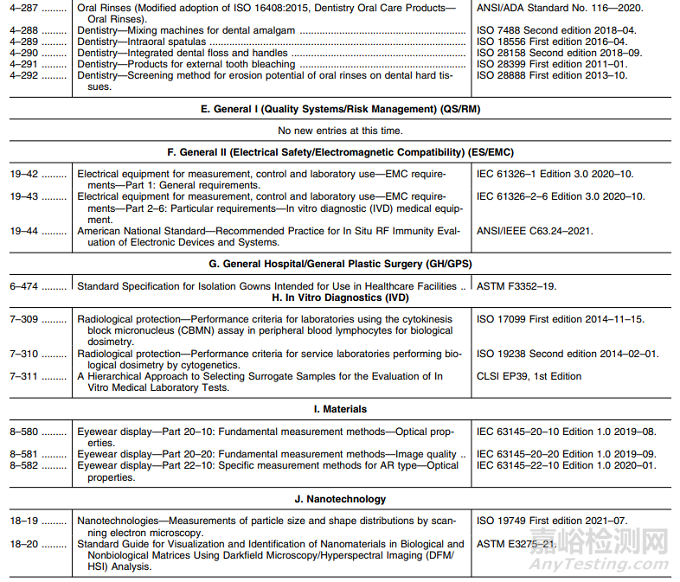
D. 牙科/耳鼻喉科:新增标准8项;
F. 一般II(电气安全/电磁兼容):新增标准3项;
G. 综合医院/综合整形外科:新增标准1项;
H. 体外诊断:新增标准3项;
I. 材料:新增标准3项;
J. 纳米科技:新增标准2项;
N. 矫形外科:新增标准4项;
O. 物理医学:新增标准1项;
Q. 软件/信息:新增标准1项;
R. 无菌:新增标准1项;
涉及以上11个领域,共新增认可标准32项。
详细信息如下:
表2——共识标准清单的新增条目
获认可的标准清单
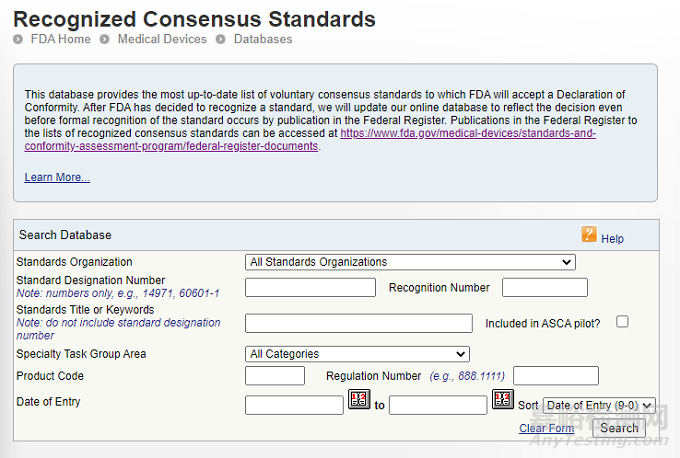
FDA 将认可共识标准的当前清单保存于一个可搜索的数据库中,该数据库可通过 https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfStandards/search.cfm访问。
此类标准是FDA已在联邦公报上发布的通知认可的标准。对于FDA已内部决定认可但尚未对其进行认可(因为定期通知尚未发布在联邦公报中),FDA 将根据需要在联邦公报中宣布对公认的共识标准清单的额外修改和修订,每年一次,或必要时更频繁地公布。
认可标准推荐
所有人都可以根据 FD&C 法案第 514 条向 CDRHStandardsStaff@fda.hhs.gov 提交此认可标准推荐,并附上理由。推荐者应考虑,此类建议应至少包含
https://www.fda.gov/medical-devices/premarket-submissions-selecting-and-preparing-correct-submission/standards-and-conformity-assessment-program#process中描述的信息。
FDA对认可标准计划的实施
在2018年9月14日的联邦公报 (83 FR 46738) 中,FDA宣布了“在医疗器械上市前提交中适当使用自愿共识标准”的指南。该指南描述了FDA 如何实施标准认可计划,可在
https://www.fda.gov/media/71983/download中了解。

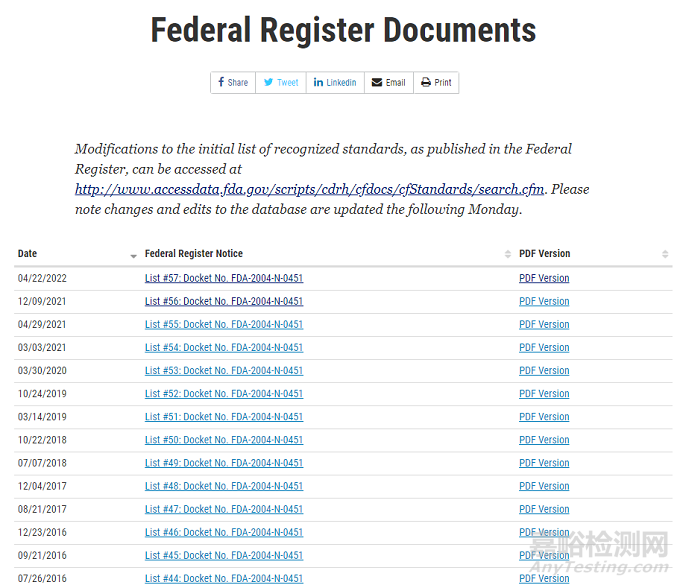
公认标准清单的修改记录
自1998年至今,FDA对初始的公认标准清单进行了57次修改,历史修改记录,发布于
https://www.fda.gov/medical-devices/standards-and-conformity-assessment-program/federal-register-documents。

来源:致众医疗器械资讯


