您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-01-04 12:59
摘 要
随着法规监管部门对持续工艺确认等GMP活动的要求不断提高,统计学在药品生产及质量控制过程的应用不断的深入,在不同的情况下如何使用各种统计分析工具成为困惑各药品生产企业的问题。本文从药品生产企业最关心的问题入手,讨论如何收集数据,如何分析数据,以及如何选用分析工具。总体而言,统计分析工具的选择应从数据分析的根本目的出发,只要能够确认工艺或产品质量是否处于受控状态的工具都是可以选用的。
随着持续工艺确认在近两年的各类GMP检查过程不断的被要求和提及,对药品生产过程产生的各种关键工艺参数(CPP),关键质量属性(CQA)以及相关的质量数据的统计和分析的要求也不断提高。如何收集数据,如何分析数据,采用什么统计分析工具来处理各种数据,已经成为困扰很多药品生产企业的问题。
关于这些话题,通过查阅相关的资料,参加相关的培训,以及与同行沟通交流,对这些问题进行了一些分析和总结,逐步形成了个人的一些理解,在此提出来与药界同行共同探讨。但在讨论如何收集数据,如何分析数据之前,我们首先要明白一个核心的问题,哪就是我们为什么要对数据进行统计分析?
关于这个问题,首先是在各国的GMP里面有明确的要求,需要对数据进行统计分析,例如,中国GMP2010版[1],第二百二十一条提到:宜采用便于趋势分析的方法保存某些数据(如检验数据、环境监测数据、制药用水的微生物监测数据);第二百五十三条提到:对投诉、召回、偏差、自检或外部检查结果、工艺性能和质量监测趋势以及其他来源的质量数据进行分析,确定已有和潜在的质量问题。必要时,应当采用适当的统计学方法;在欧盟GMP[2]6.16中提到:The results obtained shouldbe recorded. Results of parameters identified as quality attribute or ascritical should be trended and checked to make sure that they are consistent with eachother. Any calculations should be critically examined. (应当记录得到的检测结果。质量属性或关键的参数结果应当进行趋势统计和检查,确保其相互一致。任何计算都应当经过严格的检查)。
其次是不管使用任何统计方法,使用任何分析工具,最主要的目的就是要通过科学的统计分析来确认我们的产品质量或工艺过程是否处于受控状态,来识别是否存在特殊原因的变动影响产品或工艺。基于此目的,我们针对以下问题进行讨论:
1 哪些数据需要进行收集,如何进行收集?
从统计学的角度来看,统计分析的指标应对于期望获得的信息是有意义的。对于药品生产过程,通常这些数据是用来描述关键工艺参数(CPP)或关键质量属性(CQA),这点在上文提到EUGMP6.16也有类似的要求。对于制剂产品通常还需要考虑收集原料药的质量数据,很多情况下制剂成品的质量属性很大程度受到原料药的影响,例如制剂的一些工艺杂质的水平。
关于如何进行数据收集,在上文提到的中国GMP2010版,第二百二十一条提到:宜采用便于趋势分析的方法保存某些数据。所以批次数据建议是采用图表或曲线的方式,让我们能很直观的发现每一批数据是否存在异常的变动,在每增加一个新的数据时能及时的反映出来。通常可以通过建立一些受控的电子表格的方式来进行数据收集,例如作运行图。数据收集时还需要提前考虑后续选用什么分析工具来分析数据,提前将数据按照分析工具需要的格式来进行收集。数据收集之后有一个很重要的工作是数据检查,特别是对于有大量的数据时,可能经常出现数据输入错误,导致出现错误的分析结果。使用Minitab进行数据分析时,也可以先用箱线图对数据进行检查。
2持续工艺确认的数据多久进行一次分析?
关于持续工艺确认过程多久进行数据分析,很多药品生产企业都对此有疑问。从目前法规要求来看,并未有非常明确规定。但在PDA第60号技术报告[3](ProcessValidation: A Lifecycle Approach)5.3中有提到一个总体的思想:The frequency of datareview will depend heavily on risk. The period of review for various processedand sub-processed is likely to vary greatly depending upon the levels ofassociated risk and the complexity of communication document.(数据审核频次主要取决于风险大小。不同工艺和工序的审核周期因风险的水平和控制的复杂程度而不同)。
所以数据统计回顾的周期,应基于风险控制以及统计学的角度来考虑。分析的频率太高可能因数据量不够,数据分析的价值不高,积攒很多批次数据后再进行分析,可能会因分析不及时,导致各种变异不能及时发现。基于上述情况考虑,如果某产品生产频次很高,例如,每个月批次数大于20批,至少因每月进行一次回顾分析,如果日常批次数较少,每个月少于3批,三到六个月分析一次也是可以接受的。每个产品的数据回顾分析周期并不一定要进行统一,要基于生产的实际情况,应该在每个商业化产品的持续工艺确认方案中进行规定。但要确保至少每年要进行一次回顾分析,不能超出年度回顾的时限。
3 如何选用数据分析工具?
关于此问题,我们还是要回到数据统计分析的本质上来,我们进行统计分析的目的是确认产品质量和工艺是否受控,是否存在异常变动因素。基于这点考虑,我们不管选用什么工具,只要是科学合理的,不管白猫黑猫抓到老鼠就是好猫。能识别问题,找到改进或提高的机会的统计分析方法就是好方法。不一定需要使用多么专业的软件或工具,例如Minitab ,SPSS等统计分析软件。对于一些简单的数据,日常的Excel 同样能帮我们发现某些异常变动。例如表1的这组数据:
表1.某产品的溶出数据
|
批次 |
样1 |
样2 |
样3 |
样4 |
样5 |
样6 |
|
A |
96.3 |
96.5 |
96.4 |
94.2 |
96.0 |
96.0 |
|
B |
91.7 |
90.7 |
82.5 |
80.1 |
91.6 |
85.4 |
|
C |
90.5 |
89.1 |
82.0 |
75.7 |
91.9 |
89.7 |
|
D |
95.2 |
93.9 |
94.7 |
95.5 |
94.9 |
91.6 |
|
E |
97.1 |
94.9 |
95.5 |
96.5 |
96.5 |
95.0 |
采用EXCEL,做折线图,得到下图1:
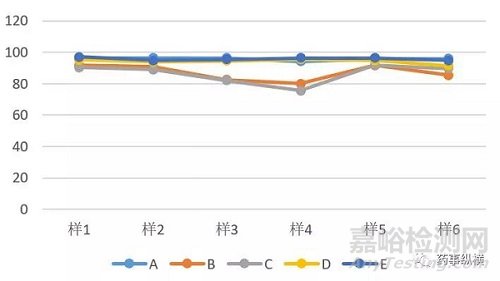
图1.某产品的溶出数据
从数据上我们可以明显的发现B,C和其他批次在第三和第四个点可能存在某些变异,需要我们进一步进行调查。用Excel也达到了我们发现问题的目的。当然,我不是要让大家弃用专业的软件,对于一些复杂的问题专业的统计分析软件能更快更好的帮我们解决一些数据统计分析的问题。
例如表2的这组数据,某公司对某产品的工艺进行了优化,优化前和优化后各有一组数据,我们要分析两组数据的均值是否有显著的差异,这种情况下,专业软件就显示出它的优势了。
表2.某产品的A成分含量
|
改进前 |
改进后 |
||
|
5.25 |
5.21 |
5.21 |
5.26 |
|
5.31 |
5.33 |
5.25 |
5.19 |
|
5.18 |
5.45 |
5.33 |
5.10 |
|
5.33 |
5.40 |
5.25 |
5.51 |
|
5.46 |
5.18 |
5.17 |
5.59 |
|
5.24 |
5.22 |
5.14 |
5.60 |
要判断两组数据均值是否有显著差异,我们可以选用双样本的t检验来判断,但是使用双样本t检验有两个前提,即要先判断数据是否符合正态分布,两组数据的方差是否齐性。使用Minitab可以很容易的完成这个分析过程,此处不再详述Minitab 的计算过程。最终t检验计算的P值为0.609,大于0.05,不能说两组数据的均值有显著的差异,所以暂不能下结论说工艺改进后均值发生了显著变化。
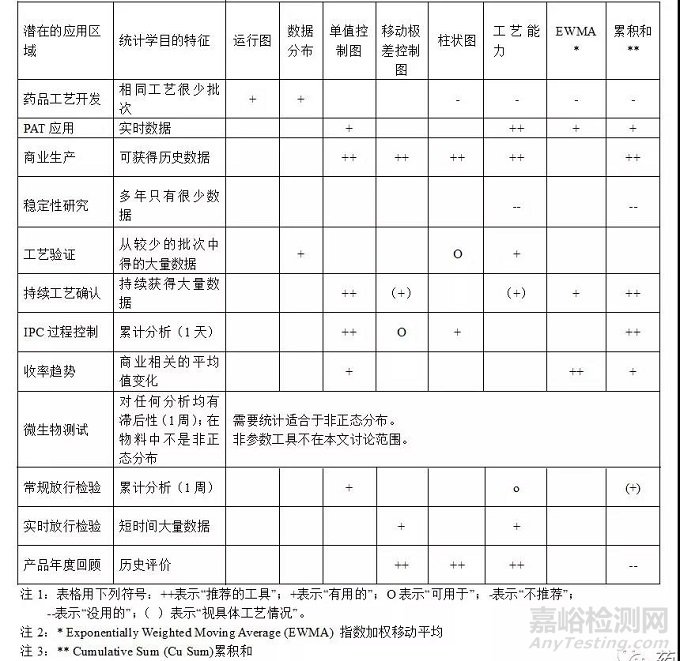
当然在什么情况下选用什么合适的分析工具,从目前从行业的法规和指南来看,只有在PDA 第59号技术报告[4](Utilization of StatisticalMethods For Production Monitoring)中有较为明确的建议,指出了不同的应用情况可以选用什么统计工具。可详见PDA TR59 表3.0.1-1。如下表3。
表3. PDA TR59 3.0.1-1 何时使用统计工具的建议和意见
3 工艺能力评估,是选用CPK还是PPK,两者有什么区别?
首先从英文的名称来看,CPK和PPK有着不同的含义。CPK的英文为capabilityprocess index,翻译为:过程能力指数。PPK的英文为:performance process index,翻译为:过程性能指数。都是用来评估工艺能力的参数,但他们有着不同的意义,从图2的计算公式可以看到他们的区别:
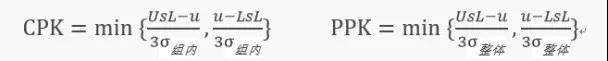
图2.CPK和PPK计算公式
上述公式中UsL表示:标准上限;LsL表示:标准下限;u表示:样本均值;σ表示:标准差。
从公式来看,CPK和PPK的计算公式基本相同,唯一的差别就是σ值不一样,CPK使用的是组内的标准偏差,PPK使用的是整体的标准偏差。CPK是通过代表性的样本来估算总体的工艺能力,PPK则是用实际的结果来显示目前实际的工艺性能。打个比方CPK是表示潜能的高低,PPK是表示实际的性能的高低。CPK和PPK值越接近表示潜能接近于实际值,表示工艺能力越趋近于稳态。CPK值和PPK值的差距也是经常被大家忽视的一个参数,其实也是能反映工艺能力的一个重要参数。用两组数据就能看到他们之间的差异。例如:下面的表4和表5的两组数据:
表4.某产品的质量数据(标准:85.0-100.0)
|
组1 |
组2 |
组3 |
|
96.3,96.5,96.4, 94.2,96.0,96.0 |
95.2,93.9,94.7 95.5,94.9,91.6 |
97.1,94.9,95.5 96.5,96.5,95.0 |
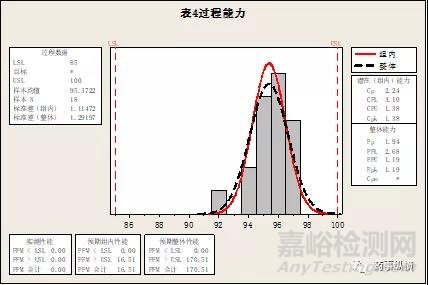
图3.表4数据的CPK和PPK
表5.某产品的质量数据(调整后)
|
组1 |
组2 |
组3 |
|
96.3,96.5,96.4 96.5,96.0,96.0 |
95.2,94.9,94.7 95.5,94.9,95.0 |
97.1,93.9,95.5 94.2,96.5,91.6 |
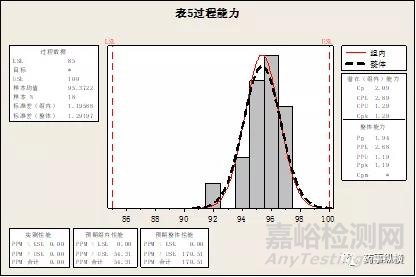
图4.表5数据的CPK和PPK
对比图3和图4,我们可以看到,同样的18个数据,我们使用Minitab软件计算出来的PPK值是相等的,都是1.19,但CPK值是不相等的,表4的CPK值为1.38,表5的CPK值为1.29。表5仅仅是将表4的部分数据在不同组别中进行了对调。当然一般我们是不能将数据在不同组别中进行对调,这里只是为了让我们更好的理解CPK和PPK的差异。从上述的例子我们可以很清晰的看到,PPK计算过程考虑的总体标准差,只要总体标准差不变,PPK是不变的,而CPK计算过程考虑的是组内的标准差,组内的标准差变动后,CPK值也发生了变化。
通常对于正态分布的数据可以同时用CPK和PPK来评价工艺的能力,例如大多数情况下,含量的数据是成正态分布,少数情况下数据存在显著的变异或没有达到稳态,或者数据统计的精度不高的情况下,也可能不成正态分布,但随着数据的累积会近似正态分布。对于不符合正态分布的数据只能选用PPK来评估工艺能力。
5 总结
总之,关于药品生产和质量控制过程中如何使用统计学的工具,我们的原则是首先参考法规或指南,例如PDATR59,在有相应的法规或指南的情况下尽量参考,但它并不一定适用于所有情况,例如非正态分布的微生物数据的分析,PDATR59中明确指出不适用。所以在这种情况下,不同的产品不同的项目,都可能需要采用不同的统计分析工具。通常对于单值的检测结果进行分析,我们首先要对数据进行检查,确认是否有录入错误,有无需要剔除的数据,确认无误后,可以运行图,控制图或直方图,查看数据的总体分布情况。
如果想查看批次间的波动情况,可以作移动极差图;如果想评估工艺能力,可以计算CPK或PPK,当然计算过程能力之前还需对数据进行正态性检验,数据符合正态分布可以用CPK,不符合正态分布可以用PPK。如果想评估工艺改进前后的均值是否有显著性差异,可以使用t检验,当然需注意的是使用t检验前需计算数据是否符合正态分布,方差是否齐性,只有满足这两点的情况下t检验才有意义。所以在使用各种工具时需要特别注意其使用的前提条件,如果前提条件不满足,往往得到是错误的结果。
如纪伯伦所说:不要因为走得太远了,忘记为什么出发。我们需要牢牢记住的是我们的初衷:我们为什么要进行数据分析,分析数据的目的不是为了使报告看起来更高端、上档次,我们的目的是为了确认工艺过程是否正常,是否存在异常或变异,是否能够通过数据分析发现改善点,能达到上述几个目的,任何科学的统计分析工具都是可以选用的。
【参考文献】
[1] 国家食品药品监督管理局.药品生产质量管理规范,2010版.
[2] European Medicines Agency. Guide to Good Manufacturing Practice forMedicinal Products.
[3] ParenteralDrug Association. Technical report 60: Process Validation: A Lifecycle Approach,2013.
[4]Parenteral Drug Association. Technical report59: Utilization of Statistical Methods for ProductionMonitoring, 2012.

来源:Internet


