您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-15 10:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
地舒单抗生物类似药报NDA。绿叶制药旗下公司博安生物开发的地舒单抗生物类似药(LY06006/BA6101)的上市申请获CDE受理。LY06006/BA6101是IgG2全人源单抗药物,为Prolia(普罗力)的生物类似药。在全球范围内,Prolia已获批用于治疗具有骨折高危风险的绝经后妇女骨质疏松症等多个适应症,该新药在中国也于2020年6月获批上市。目前,LY06006/BA6101也在欧美同步开展Ⅰ期临床。
国内药讯
1.武田P-CAB在华获批新适应症。武田富马酸伏诺拉生片(vonoprazan)新适应症获国家药监局批准,获批的新适应症推断为“与其它抗菌药联用治疗幽门螺杆菌感染”。vonoprazan是一款新型钾离子竞争性酸阻滞剂(P-CAB),在日本已获批用于治疗反流性食管炎、胃溃疡、十二指肠溃疡、预防胃溃疡或十二指肠溃疡的复发和幽门螺杆菌的根除等适应症。在中国,NMPA已批准vonoprazan用于反流性食管炎的治疗。
2.金妥利珠单抗获FDA孤儿药资格。长春高新旗下金赛药业金妥利珠单抗(gentulizumab)注射液获FDA授予孤儿药资格,用于治疗急性髓系白血病。目前gentulizumab也正在国内开展两项用于治疗晚期恶性实体瘤和淋巴瘤、及血液系统恶性肿瘤的Ⅰa期临床。这两项试验均有一项排除标准为:接受过以CD47/SIRPα通路为靶点的治疗,且关键次要终点之一均为gentulizumab在外周血中红细胞、白细胞、血小板等表面CD47的受体占有率(RO)。推测gentulizumab可能是一款CD47靶向单抗。
3.超速效赖脯胰岛素获批III期临床。通化东宝超速效赖脯胰岛素注射液(THDB0206)获CDE批准平行开展I期和III期临床。THDB0206是法国SA ADOCIA公司开发的一款新一代速效胰岛素类似物产品,全球范围内同类药品仅有诺和诺德的Fiasp®和礼来的Liumjev®,通化东宝拥有THDB0206在大中华地区、马来西亚、新加坡等国家独家临床开发、生产和商业化权利。
4.奥布替尼治疗MS在华上Ⅱ期临床。渤健和诺诚健华联合宣布,双方合作开发的BTK抑制剂奥布替尼用于治疗多发性硬化(MS)II期临床在中国完成首例受试者给药。这是一项国际多中心临床研究,正在美国、欧洲和中国同步开展。该新药此前在国内已获批治疗复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、以及复发/难治套细胞淋巴瘤。
5.天境CLDN18.2/4-1BB双抗报IND。天境生物CLDN18.2/4-1BB双抗TJ033721(TJ-CD4B)注射液的临床试验申请获CDE受理。临床前研究表明,即便在Claudin 18.2低表达的情况下,TJ-CD4B仍能与肿瘤病灶结合,产生优于其它4-1BB单抗的免疫活性,特别是4-1BB全新的结合表位特点,有助于产生长久的免疫应答。目前该新药正在美国开展用于治疗晚期或转移性实体瘤的I期临床(NCT04900818),天境生物计划同步在国内开展TJ-CD4B的相关剂量爬坡研究。
国际药讯
1.Keytruda组合一线治疗宫颈癌获FDA批准。FDA批准默沙东PD-1抑制剂帕博利珠单抗(Keytruda)与含铂化疗联用,加或不加bevacizumab,一线治疗PD-L1(CPS分数≥1)表达、复发/转移性宫颈癌患者。在一项Ⅲ期临床中,与化疗相比,Keytruda联合化疗将这类患者死亡风险降低36%(HR=0.64;95% CI:0.50,0.81;p=0.0001),两组中位PFS分别为10.4个月和8.2个月(HR=0.62;95% CI:0.50,0.77;p<0.0001),客观缓解率分别为68%和50%,中位缓解持续时间分别为18.0个月和10.4个月。
2.礼来CDK4/6抑制剂获批治疗早期乳腺癌。礼来CDK4/6抑制剂Verzenio(abemaciclib)获FDA批准扩展适应症,联合内分泌疗法用于辅助治疗HR+、HER2-、淋巴结阳性且Ki-67评分≥20%、高复发风险的早期乳腺癌患者。在一项Ⅲ期临床中,与内分泌疗法单药相比,Verzenio联合内分泌疗法将这类患者复发的风险降低约36%(HR=0.643,95% CI: 0.475,0.872,p=0.0042)。FDA此前已批准Verzenio一线治疗HR+/HER2-晚期乳腺癌。
3.BMS多发性硬化新药长期疗效积极。百时美施贵宝S1P受体调节剂Zeposia(ozanimod)在治疗复发型多发性硬化(MS)患者的Ⅲ期临床中获长期疗效结果。在接受治疗36个月和48个月时,无疾病复发的患者比例分别为75%和71%。在13.9%的患者中观察到3个月确认残疾进展,在11.4%的患者中观察到6个月确认残疾进展。而且Zeposia的安全性特征与此前结果一致。今年7月,这款新药在中国递交了NDA申请。
4.PD-1抑制剂组合Ⅲ期临床成功。赛诺菲与再生元联合开发的PD-1疗法Libtayo(cemiplimab)在治疗晚期非小细胞肺癌(NSCLC)的Ⅲ期临床EMPOWER-Lung 3中获阳性结果。与化疗相比,Libtayo联合化疗显著延长患者的OS(中位OS:22个月vs13个月),使死亡风险降低29%(HR=0.71;95%CI:0.53-0.93;p=0.014);显著延长PFS(中位PFS:8个月vs5个月)、使疾病进展或死亡风险降低46%(HR=0.54;95%CI:0.44-0.70;p<0.0001);而且该试验中没有发现新的安全信号。
5.基因编辑公司Intellia将开发眼科用药。诺奖得主Jennifer Doudna博士创建的基因编辑公司Intellia与SparingVision公司达成一项战略性合作,将利用其专有的CRISPR/Cas9体内基因组编辑技术,针对SparingVision所选的靶点开发多达3个眼科候选药物。SparingVision将负责并资助合作基因组编辑候选疗法的临床前和临床期开发。此外,双方还将研发新型的自动失活AAV载体和LNP递送方法,旨在将药物递送到视网膜。
6.武田布局罕见遗传代谢障碍新型细胞疗法。Immusoft与武田签署一项合作许可协议,将利用Immusoft的免疫系统编程ISP技术平台,开发和商业化能够穿越血脑屏障递送蛋白治疗药物,用于治疗罕见遗传代谢障碍。根据该协议,Immusoft将获得一笔预付款和研究经费,以及里程碑后期付款,总金额可超过9亿美元。武田将负责合作产品的临床前、临床开发以及商业化。
7.Withings健康智能手表获FDA认可。FDA批准Withings公司最新款智能手表ScanWatch应用于检测心房颤动和测量血氧水平。ScanWatch内置具有医疗级心电图(ECG)和PPG(光电容积描记术),支持30秒快速测量心电图,以监测用户是否患有心房颤动(AFib)并提示潜在风险。内置的SpO2(脉搏血氧饱和度)传感器还能够整夜检测SpO2、心率、呼吸频率和运动,来测量睡眠呼吸暂停的指标。这是FDA认可的、可应用于这两类健康功能的首款智能手表。
医药热点
1.四川大学华西天府医院开院。10月13日,四川大学华西天府医院开院。依托四川大学华西医院,华西天府医院将以微创、介入为特色,构建多学科融合的危急重症医学、心血管系统、呼吸系统等特色医疗集群,为患者提供一站式精准医疗服务,同时与华西医院实现医疗学科功能互补。医院设置床位1200张、手术室66间,开放临床科室37个、医技科室9个。
2.国家呼吸医学中心临床基地落成。广州实验室暨广州医科大学附属第一医院国家呼吸医学中心临床基地近日落成。该临床基地将致力于围绕呼吸学科及相关体系的建设,重点打造呼吸内科、胸外科、变态反应科、重症医学科以及中西医结合科等;同时,通过呼吸学科辐射引领带动其他交叉学科融合发展。该基地是呼吸系统疾病疑难重症诊治中心,同时也是培训中心、研究中心和国际学术交流中心。
3.中国学生营养与健康促进会学校卫生分会成立。近日,中国学生营养与健康促进会学校卫生分会成立大会暨2021年中国学校卫生工作学术研讨会在北京举行。大会选举产生了第一届学校卫生分会委员会成员,其中北京大学儿童青少年卫生研究所副所长马迎华教授当选为第一届主任委员。分会未来将致力于学校卫生管理相关法律法规和标准的宣传、开展继续教育和人员培训、制定相关团体标准、开展科学研究与学术交流合作等方面工作。
4.安徽强化民营医院党建工作。安徽省委组织部等多部门印发《关于加强民营医院党的建设工作的意见(试行)》,进一步强化党对民营医院的领导,促进民营医院持续健康发展。《意见》明确,有3名以上正式党员的民营医院,都应单独成立党组织,要推进党组织班子成员进入医院决策层和管理层,建立健全党组织与决策层、管理层日常沟通协商机制。
评审动态
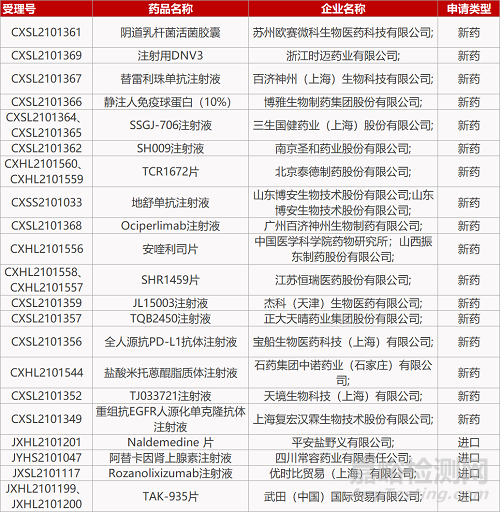
申请临床:
苏州欧赛微科生物的阴道乳杆菌活菌胶囊、浙江时迈药业的注射用DNV3、百济神州的替雷利珠单抗注射液、博雅生物的静注人免疫球蛋白(10%)、三生国健的SSGJ-706注射液(2个规格)、南京圣和的SH009注射液、北京泰德制药的TCR1672片(2个规格)、山东博安生物的地舒单抗注射液、广州百济神州的Ociperlimab注射液、中国医学科学院药物所/山西振东制药的安喹利司片、江苏恒瑞的SHR1459片(2个规格)、杰科(天津)生物的JL15003注射液、正大天晴的TQB2450注射液、宝船生物医药的全人源抗PD-L1抗体注射液、石药集团中诺药业的盐酸米托蒽醌脂质体注射液、天境生物的TJ033721注射液、上海复宏汉霖的重组抗EGFR人源化单克隆抗体注射液、平安盐野义的Naldemedine 片、四川常容药业的阿替卡因肾上腺素注射液、优时比的Rozanolixizumab注射液、武田的TAK-935片(2个规格)。
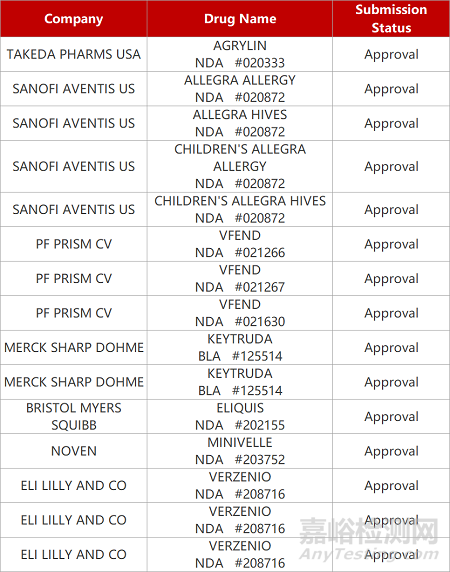
申请生产:

来源:药研发


