您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-27 20:31
近日,器审中心发布了青岛中皓生物工程有限公司的脱细胞角膜植片注册技术审评报告,我们一起来了解下脱细胞角膜植片在临床前研发阶段多了哪些检测实验。
一、产品概述
(三)型号规格 型号:CH-aPCS;规格:Φ8.5±0.85mm/δ500±50μm(CH-aPCS 500);Φ8.5±0.85mm/δ300±30μm(CH-aPCS 300);
(四)作用机理 经手术将申报产品植入后,有利于人体的角膜基质细胞 就迁入和增殖,预期形成新的具有与自身形态和功能相适应 的角膜组织。
二、临床前研究摘要
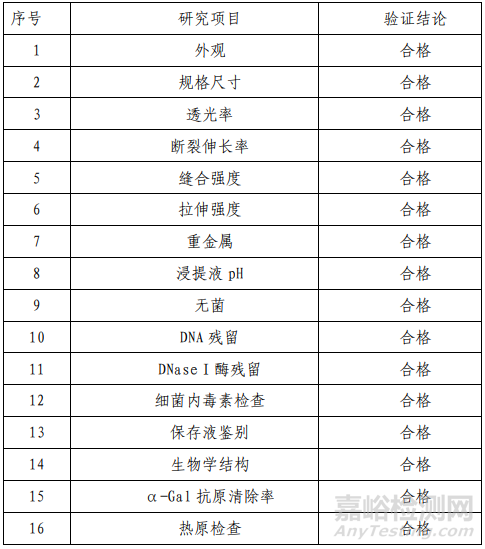
表 1 产品技术要求研究摘要
除技术要求研究项目外,产品性能评价还包括包装材料与保存液长期接触的相互作用、辐照灭菌对产品包装材料性能的影响、保存液和产品之间的相互作用、助剂残留、乙醇残留、保存液残留、产品中非胶原蛋白、多糖、磷脂质、核酸物质含量分析等性能验证,并对溶胀除上皮层、反复冻融、生物酶处理、风干、灭菌等工艺进行了验证,从而确认了生产工艺及其关键控制点,结果表明产品符合设计输入要求。
(三)生物安全性
申请人按照 YY/T 0771 动物源医疗器械系列标准对动物 源原料来源、收集与处置的控制进行风险管理,对辐照去除/灭活病毒度工艺进行了研究。生物安全性研究资料显示 产品在病毒、其他病原体感染方面的风险可接受。
申请人提供了免疫原性风险评价资料,该产品与已在 境内上市产品在动物种类、取材组织、处理工艺原理等免 疫原性相关方面进行了对比分析,并提供免疫原性风险评价相关文献数据。选择残留DNA数量和α-Gal抗原清除率作 为免疫原性质量控制项目并列入产品技术要求。综合上述 内容认为产品生物安全性风险可以接受。
该产品无菌状态提供,采用 60Co 辐照灭菌,剂量 25kGy。申请人提供了灭菌确认报告,证明无菌保证水平达到 10-6。
该产品储运温度为2~8℃,有效期为6个月。申请人提 供了有效期的验证报告。验证试验为加速老化和实时老 化,包括产品稳定性和包装完整性。
动物试验目的为评价脱细胞角膜植片原位植入于新西兰兔、比格犬、猕猴角膜的有效性和安全性。定期使用裂隙灯、角膜测厚仪、眼压计、OCT、活体共焦显微镜进行在体研究,移植动物处死后利用茜素红染色、扫描电镜、透射电镜、HE染色等进行研究。
通过植片透明度、植片水肿程度、植片新生血管对脱细胞角膜植片有效性进行评价,角膜移植180天后角膜移植有效率为93.33%,H.E染色结果显示术眼移植区胶原板层排列规则、紧密,周围无炎症细胞分布,初步证明脱细胞角膜植片替代供体角膜进行角膜移植的可行性。
比格犬移植后12m-40m,OCT检查图像及活体共焦显微镜照片初步显示植片宿主化。动物试验同时对脱细胞角膜植片安全性进行评价,血常规及其各项生化指标未见明显异常。

来源:国家药监局


