您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-20 10:57
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
江苏奥赛康IL-15前药报IND。江苏奥赛康生物注射用ASKG315的临床试验申请获CDE受理,拟开发用于恶性晚期实体瘤的治疗。SKG315是奥赛康子公司自主研发的重组人白介素-15前药-Fc融合蛋白。多种临床前药效研究结果显示,ASKG315具有较高的结合及活性作用,对多个肿瘤模型均具有显著抑制肿瘤生长作用。此外,ASKG315较长的半衰期可支持临床应用中更长的给药间隔。
国内药讯
1.恒瑞HER2-ADC启动乳腺癌Ⅲ期临床。恒瑞医药自主研发的HER2靶向抗体偶联药物(ADC)注射用SHR-A1811登记启动一项Ⅲ期临床,评价在晚期阶段接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性转移性乳腺癌患者中SHR-A1811的无进展生存期是否优于吡咯替尼联合卡培他滨。该试验计划入组269例患者,项目的主要研究者由中山大学孙逸仙纪念医院宋尔卫主任医师和姚和瑞主任医师共同担任。
2.临床急需用药「酚妥拉明」拟纳入优先审评。成都欣捷公司甲磺酸酚妥拉明注射液的上市申请以“临床急需的短缺药品”为由获CDE拟纳入优先审评,用于控制嗜铬细胞瘤患者在手术治疗前和手术过程中的阵发性高血压;预防去甲肾上腺素外溢引起的皮肤坏死和腐烂。甲磺酸酚妥拉明是短效的非选择性α-受体(α1、α2)阻滞剂,是常用急救药品,目前已有多款产品在中国获批上市。
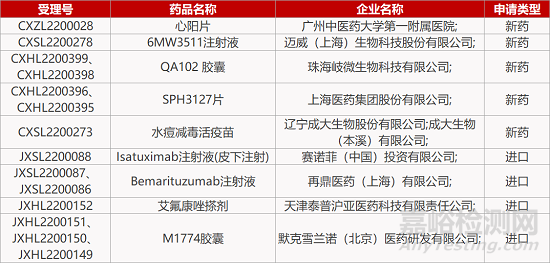
3.赛诺菲CD38抗体皮下制剂在华报IND。赛诺菲isatuximab注射液(皮下注射)的临床试验申请获CDE受理。isatuximab(Sarclisa)是一款CD38单抗,其静脉给药剂型已获得FDA批准,用于与泊马度胺和地塞米松联用治疗成年多发性骨髓瘤(MM)经治患者,以及与卡非佐米和地塞米松(Kd)联用治疗既往接受过1-3种前期治疗的复发/难治性MM患者。目前,isatuximab皮下制剂正在海外Ⅲ期临床中用于治疗复发/难治性MM患者。
4.迈威PD-L1/TGF-β双靶点新药报IND。迈威生物1类生物药6MW3511注射液的临床试验申请获CDE受理,拟用于多种晚期实体瘤的治疗。6MW3511是一款人源化抗PD-L1的纳米抗体连接TGF-β RII突变体的双功能基团药物蛋白,可通过同时阻断PD-1/PD-L1和TGF-β/TGF-β-R双通路,以及较高的肿瘤局部穿透性,解决肿瘤微环境免疫抑制的难题。临床前研究结果显示,6MW3511具有良好的体内抗肿瘤药效和较好的动物耐受性。
5.上海医药CD20单抗皮下制剂报IND。上海医药重组抗CD20人源化单克隆抗体皮下注射液(B007)的临床试验申请获CDE受理,适应症为CD20阳性的B细胞非霍奇金淋巴瘤。B007用于这一适应症的临床开发已于去年11月启动Ia期临床试验,目前正处于Ib期临床阶段。与静脉注射相比,皮下注射给药可大幅缩短给药时间(从大约2小时缩短至5分钟),降低治疗费用,提高用药便捷性和患者满意度。
6.上海医药引进四环医药2款抗感染新药。四环医药旗下轩竹生物与上海医药附属公司上药新亚达成许可协议,上药新亚将获得轩竹生物的两款抗感染新药百纳培南及Plazomicin原料药和制剂在大中华区(包括中国大陆、香港、澳门和台湾)的独家授权,并将成为两款产品在大中华区的上市许可持有人(MAH)。根据协议,轩竹生物将获得2100万元人民币的预付款,最高不超过4.19亿元人民币的里程碑付款,以及产品的销售分成。
国际药讯
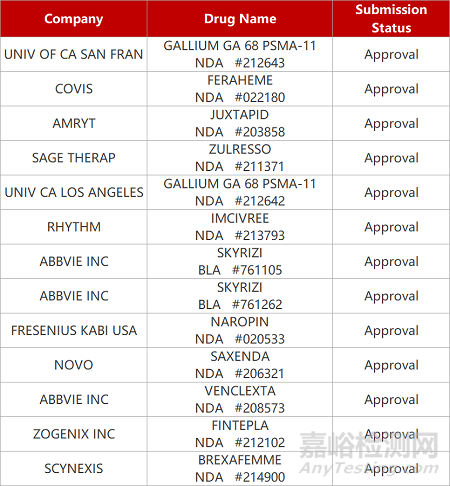
1.FDA批准肥胖症新药用于治疗BBS。FDA批准Rhythm制药公司MC4受体激动剂Imcivree(setmelanotide)新适应症,用于Bardet-Biedl综合征(BBS)患者的体重管理,这类罕见病患者会经历无法满足的饥饿(贪食症)和早发严重肥胖。在Ⅲ期临床中,Imcivree显著降低患者的体重和饥饿感,第52周时患者体重平均减轻7.9%,饥饿评分降低2.1分。2020年,Imcivree首次获FDA批准,用于POMC、PCSK1或LEPR缺陷型肥胖症。
2.艾伯维IL-23抗体获批治疗克罗恩病。艾伯维IL-23抑制剂Skyrizi(risankizumab)获FDA批准,用于治疗中重度克罗恩病(CD)患者。IL-23是一种参与炎症过程的细胞因子,与许多慢性免疫介导的疾病有关。此前,FDA已批准Skyrizi用于治疗适合接受全身治疗或光疗的成人中/重度斑块状银屑病,以及用于治疗成人活跃银屑病关节炎。
3.子宫肌瘤创新疗法获欧盟批准。欧盟委员会(EC)批准ObsEva与Theramex联合开发的口服促性腺激素释放激素拮抗剂Yselty(linzagolix)上市,用于治疗>18岁、患有中重度子宫肌瘤的成人患者,无论子这些患者是否接受内分泌反向添加(ABT)治疗。两项Ⅲ期临床结果显示,200mg Yselty联合ABT治疗的缓解率为84.5%;100mg Yselty单药治疗的缓解率为56.5%。在美国,linzagolix正在接受FDA的审核。
4.ADH1创新疗法Ⅱ期临床积极。BridgeBio公司口服钙敏感受体拮抗剂encaleret治疗1型常染色体显性低钙血症(ADH1)的Ⅱb期临床结果积极。encaleret治疗第24周时,有92%(12/13)的患者可以在没有在饮食外补充钙与维生素D的情形下,达到稳定正常血钙浓度;77%(10/13)患者可观察到正常尿钙排出的现象。临床中未发生严重的不良反应。详细结果将在ENDO2022年会上发布。
5.双重机制PD-L1抗体皮肤癌关键临床积极。Checkpoint公司基于T细胞和自然杀伤细胞的双重作用机制的PD-L1抗体cosibelimab,在治疗皮肤鳞状细胞癌的关键临床结果积极。Checkpoint已在今年1月公布该药用于转移性皮肤鳞状细胞癌(cSCC)患者的积极顶线结果。此次公布的是该药在局部进展性皮肤鳞状细胞癌患者中的积极中期结果。在可评估患者中,ICR评估的客观缓解率达到54.8%(95% CI:36.0-72.7)。预计Checkpoin将在今年向FDA递交cosibelimab的上市申请。
6.协和麒麟拟10亿美元出售部分海外资产。日本协和麒麟正在考虑出售部分海外资产,交易价格可能达到10亿美元。此次计划出售的资产涉及其子公司协和麒麟国际的一些成熟品牌药。目前交易尚处于初期阶段。最新年报显示,麒麟控股拥有协和麒麟约54%的股份。协和麒麟国际的前身为ProStrakan,总部位于苏格兰,拥有500多名员工。
医药热点
1.甘肃省:80%以上的县级中医院达“二甲”水平。甘肃省卫健委等8部门联合印发《甘肃省基层中医药服务能力提升工程“十四五”行动计划》指出,到2025年,80%以上的县级中医医院达到“二级甲等中医医院”水平,全部乡镇卫生院、社区卫生服务中心设置中医馆,10%的社区卫生服务站、村卫生室设置“中医阁”,二级妇幼保健院开展中医药专科服务的比例达70%。
2.山西省首家肿瘤日间放疗门诊开诊。日前,山西省首家“肿瘤日间放疗门诊”在山西医科大学第一医院开诊。肿瘤患者无需办理住院手续,在门诊即可进行放化疗治疗,而且医疗费用可按照医保政策报销,不仅治疗方便而且费用也大大节省。肿瘤日间放疗门诊还可以为患者提供“恶性肿瘤门诊治疗”慢性病相关医保政策咨询;开展科普宣教活动,推广全病程管理模式,借助手机APP工具,实施良好的动态诊疗干预管理。
3.猴痘病毒在实验室气溶胶中具感染性可超90小时。6月16日新一期的国际顶级医学杂志《柳叶刀》上,来自英国莱斯特大学的一支呼吸科团队报告指出,不应排除猴痘病毒气溶胶传播的可能。而美国杜兰大学的研究者在一项早前的研究中即已证实,猴痘病毒能够在实验室控制下的气溶胶悬浮液中存活超过90小时,并显示出可能在空气环境中长时间保持传染性的能力。
评审动态

来源:药研发


