您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-12 10:50
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
中国新药注册临床年度报告出炉。CDE发布《中国新药注册临床试验现状年度报告(2020年)》,首次对中国新药注册临床试验现状汇总分析。2020年共登记临床试验2602项,较2019年增长9.1%。化学药(约73.6%)和生物制品(23.8%)占比较高,其中新疗法在生物制品中的占比达到4.3%;化药、治疗用生物制品、预防用生物制品和中药的注册分类中占比最高的均为1类,分别为71%、65.4%、46.0%和61%;靶点主要为PD-1、VEGFR、PD-L1等,细胞治疗仍以CD19靶点为主。
国内药讯
1.司美格鲁肽启动抗AD国际Ⅲ期临床。诺和诺德口服司美格鲁肽(semaglutide,GLP-1类似物)在中国登记启动一项用于治疗早期阿尔茨海默病患者的Ⅲ期临床(EVOKE plus)。这是一项国际临床项目,计划在中国境内入组115人,在国际入组1840人。首都医科大学宣武医院主任医师贾建平教授将担任中国临床研究的主要研究者。来自semaglutide治疗糖尿病的三项大型心血管结局试验(LEADER、SUSTAIN 6和PIONEER 6)的事后分析显示,服用GLP-1的患者痴呆症的发生率显著降低了53%。
2.澳宗生物TTYP01获ALS孤儿药资格。苏州澳宗生物依达拉奉改良型新药TTYP01片获FDA授予孤儿药资格,用于治疗肌萎缩侧索硬化症(ALS,俗称渐冻人症)。澳宗生物在已上市依达拉奉注射剂型的安全性和有效性数据基础上,通过特有的专利技术改变给药途径,将依达拉奉注射剂改良成口服的片剂,可为患者提供长达一年以上的持续治疗。在中国,TTYP01片的NDA申请预计将于明年获批。
3.勤浩医药SHP2抑制剂获批临床。勤浩医药1类新药GH21胶囊获国家药监局临床试验默示许可,拟开发用于晚期实体瘤的治疗。GH21是一款小分子SHP2抑制剂,已在临床前研究中显示出极强的生物活性,对多种SHP2点突变体有效;并具有脱靶风险低,GH21代谢性质优异,口服生物利用度高和安全性良好的特点。2020年9月,勤浩医药已将GH21的中国以外的开发和商业化权利授予沪亚生物。
4.新型钙通道阻滞剂获批PSVT临床。箕星药业引进的鼻喷雾剂etripamil获国家药监局临床试验默示许可,拟开发用于治疗成人阵发性室上性心动过速(PSVT)发作,快速转复为窦性心律。etripamil是Milestone公司开发的一款新型钙通道阻滞剂,目前处于治疗PSVT的Ⅲ期临床阶段,以及治疗心房颤动伴快速心室率(AFib-RVR)患者的Ⅱ期概念验证试验阶段。
5.默沙东ROR1-ADC报IND。默沙东ROR1-ADC新药zilovertamab vedotin(MK-2140)的临床试验申请获CDE受理。ROR1(受体酪氨酸激酶样孤儿受体1)是一种跨膜受体,它存在于多种血液系统恶性肿瘤中,包括慢性淋巴细胞白血病 (CLL)、套细胞淋巴瘤 (MCL) 和弥漫性大B细胞淋巴瘤 (DLBCL)。MK-2140是国内首款申报临床的ROR1 ADC。目前全球尚无同靶点药物获批上市;同类药物开发进度最快的是Oncternal公司处于II期阶段的cirmtuzumab。
6.天境生物与济川药业达成战略合作。济川药业与天境生物就后者拟用于儿童生长激素缺乏症的伊坦生长激素(eftansomatropin alfa,TJ101)达成战略合作,济川药业将获得这款长效重组人生长激素TJ101在中国大陆地区的开发、生产及商业化的独家许可。根据协议,天境生物将获得人民币2.24亿元(不含税)的首付款、不超过人民币17.92亿元(不含税)的开发及销售里程碑付款,以及产品的销售提成。
国际药讯
1.艾力雅在欧盟和日本报新适应症。拜耳阿柏西普眼内注射溶液Eylea(艾力雅®)已在欧盟和日本提交新的适应症申请,用于早产儿视网膜病变(ROP)的治疗。Eylea是一种新型玻璃体内注射用VEGF抑制剂,是一种重组融合蛋白。在一项Ⅲ期FIREFLEYE研究中,与激光手术相比,Eylea治疗的成功率更高(85.5%vs82.1%),而且Eylea的安全性和耐受性良好。
2.蘑菇致幻成分治疗抑郁Ⅱb期临床积极。COMPASS Pathways裸盖菇素疗法COMP360治疗难治性抑郁症的Ⅱb期临床达到主要终点。与1 mg COMP360组(对照组)相比,25 mg COMP360组第3周时评估抑郁症状的MADRS评分降低6.6(p<0.001),而且第12周时获得持续缓解的患者比例更多(24.1%vs10.1%)。该新药通常耐受良好。裸盖菇素(psilocybin)是源于毒蘑菇中的致幻活性成分。
3.TIL疗法联合PD-1治疗实体瘤临床积极。Iovance Biotherapeutics公司TIL疗法lifileucel联合PD-1抑制剂帕博利珠单抗(Keytruda)一线治疗晚期实体瘤的临床结果积极。最新数据显示,这一组合在宫颈癌患者中ORR达到50.0%;在转移性黑色素瘤和颈部鳞状细胞癌患者中ORR分别为87.5%和ORR为42.9%。所有队列的不良事件特征与已知的不良事件特征一致。
4.创新TCR免疫疗法组合早期临床积极。Immunocore公司靶向TCR/CD3的免疫疗法tebentafusp联合PD-L1抑制剂durvalumab和/或CTLA4抑制剂tremelimumab治疗转移性皮肤黑色素瘤(mCM)的Ⅰb期临床结果积极。在免疫检查点抑制剂经治患者中,tebentafusp加durvalumab联合/不联合tremelimumab的最大目标剂量在双联和三联组中均可耐受;tebentafusp治疗的1年总生存率(OS)达到76%。详细结果将在SITC2021年会上公布。
5.基因泰克布局微生物组学疗法。Novome公司与罗氏旗下基因泰克达成一项合作和许可协议,将利用Novome专有的基因工程微生物药物(GEMMs)平台,联合开发用于人类肠道疾病的治疗性工程菌定植疗法。根据协议,Novome将获得1500万美元的预付款,可能高达5.9亿美元的潜在里程碑付款。Novome将负责合作项目的临床前研究,基因泰克将负责候选药物的临床开发和商业化。
6.辉瑞引进两款偏头痛药物。辉瑞与Biohaven公司就后者的两款偏头痛药物(Rimegepant和Zavegepant)达成许可协议,辉瑞将获得这两款新药在美国境外商业化权利。Rimegepant是唯一一款获FDA批准用于治疗急性偏头痛和预防偏头痛发作的口服CGRP拮抗剂;Zavegepant正在III期临床中评估治疗偏头痛的潜力,此外,它还在临床中用于治疗新冠病毒感染和哮喘。根据协议,Biohaven将获得5亿美元首付款、7.4亿美元的里程碑付款,以及产品的销售分成。
医药热点
1.中西医结合医学中心设置标准发布。国家卫健委、国家中医药管理局联合发布《国家中西医结合医学中心(综合医院)设置标准》。《设置标准》强调,国家中西医结合医学中心(综合医院)应为中西医结合诊疗水平全国领先的三级甲等综合医院,具备涵盖多个专业的独立设置中西医结合或中医科室,中西医结合、中医执业医师占全院医师比例不低于10%。
2.英国国家医疗服务体系濒临崩溃。据英媒报道,英国国家医疗服务体系(NHS)联合会近期进行的一项调查显示,NHS目前有超过9万人的岗位空缺,社会保障方面的人员缺乏更为严重。人员短缺问题已导致医院、诊所和急诊部门很难应对日益增长的需求,患者安全无法得到保障,面临巨大风险。
评审动态
1. CDE新药受理情况(11月11日)
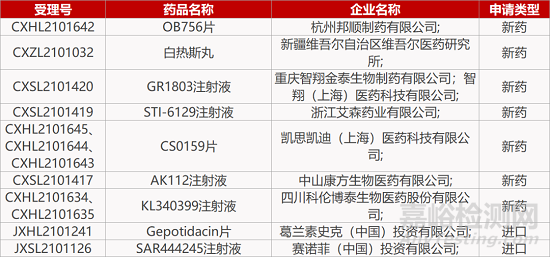

来源:药研发


