您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-23 11:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
复星PD-1单抗新适应症报NDA。上海复星医药旗下复宏汉霖自主研发的PD-1抗体斯鲁利单抗注射液的上市申请获CDE受理,拟联合卡铂和白蛋白紫杉醇一线治疗局部晚期或转移性鳞状非小细胞肺癌。这是斯鲁利单抗报产的第二个适应症,其用于经标准治疗失败的、不可切除或转移性高度微卫星不稳定型(MSI-H)实体瘤的上市申请已被CDE纳入优先审评。
国内药讯
1.信迪利单抗两项Ⅲ期临床积极。信达生物在ESMO 2021会议上公布信迪利单抗两项Ⅲ期临床研究的积极结果。在ORIENT-15研究中,信迪利单抗联合化疗一线治疗食管鳞癌达到全部研究终点,显著延长患者的中位总生存期(mOS)(mOS:16.7个月vs12.5个月,HR为0.628)和中位无进展生存期(mPFS)(7.2个月vs5.7个月,HR为0.558),降低死亡风险37.2%。在ORIENT-16研究中,信迪利单抗联合化疗一线治疗胃癌在CPS≥5人群和总体人群中均显著延长mOS(18.4月vs12.9月;15.2月vs12.3月)。
2.普那布林治疗NSCLC的III期临床积极。万春医药在ESMO2021上公布普那布林联合多西他赛治疗EGFR野生型非小细胞肺癌的国际III期研究(DUBLIN-3)详细结果。与化疗相比,联合治疗显著延长患者的生存期,中位OS为10.5个月vs9.4个月,24个月OS率(22.1%vs12.5%)、36个月OS率(11.7%vs5.3%)以及48个月OS率(10.6%vs0%)均有显著提升;两组中位PFS为3.6个月vs3.0个月,ORR为12.23%vs 6.76%;而且联合治疗组的4级中性粒细胞减少症的发生率显著下降。
3.第三代紫杉烷类衍生物获批临床。贝海生物2.2类新药BH002注射液获国家药监局临床试验默示许可,拟开发用于治疗接受过多西他赛治疗方案的转移性去势抵抗性前列腺癌患者。BH002是卡巴他赛改良型新药,属于第三代紫杉烷类衍生物。在临床前研究中,BH002已显示出可显著提高抗肿瘤活性和临床安全性。今年3月,BH002已获得FDA的临床试验许可。
4.上海璧辰ABM-1310国内报IND。璧辰(上海)医药新一代BRAF抑制剂ABM-1310胶囊的临床试验申请获CDE受理。ABM-1310具有高选择性与水溶性等优点,而且在透过血脑屏障方面具有显著的独特优势,有望为肿瘤脑转移患者带来更好的治疗选择方案。目前全球共有3款BRAF抑制剂上市,分别为维罗替尼、达拉替尼与恩科拉替尼。ABM-1310目前正在美国开展I期临床,本次为国内首次申报临床。
5.云顶新耀引进第三代BTK抑制剂。云顶新耀与苏州信诺维公司和香港中国抗体制药公司达成一项独家授权许可协议,以在全球范围内开发、生产制造和商业化BTK抑制剂XNW1011(中国抗体研发代号:SN1011)用于治疗肾病。根据协议,云顶新耀将向信诺维和中国抗体支付1200万美元的预付款(中国抗体400万美元、信诺维800万美元)和总额达5.49亿美元(中国抗体1.83亿美元、信诺维3.66亿美元)的里程碑后付款,以及产品的销售分成。
国际药讯
1. 外用JAK抑制剂治疗皮炎获批上市。FDA批准Incyte公司选择性JAK1/JAK2抑制剂芦可替尼(Opzelura)乳膏上市,用于短期和非连续长期治疗12岁以上轻中度特应性皮炎(AD)患者。在两项Ⅲ期临床中,与赋形剂组相比,芦可替尼治疗组8周后患者达到主要终点的患者比例更高。Opzelura是FDA批准的首个JAK抑制剂外用制剂。
2.创新ADC治疗宫颈癌获加速批准。FDA加速批准Genmab与Seagen联合开发的“first-in-class”抗体偶联药物Tivdak(tisotumab vedotin-tftv)上市,用于治疗接受化疗治疗后出现进展的复发或转移性宫颈癌患者。在临床试验中,Tivdak在这类患者中达到24%的客观缓解率(95% CI,15.9-33.3),中位缓解持续时间为8.3个月。这是治疗这一患者群体的首款获批ADC。
3.英国批准Orladeyo预防性治疗HAE。英国国家卫生与临床优化研究所批准BioCryst制药血浆激肽释放酶抑制剂Orladeyo(berotralstat)纳入英国国家卫生服务(NHS),每日口服一粒,用于在12岁及以上的患者中预防遗传性血管水肿(HAE)发作。Orladeyo是首个获批用于这类患者的口服疗法。在一项关键Ⅲ期APeX-2试验中,与安慰剂相比,Orladeyo显著减少了HAE发作,而且长期疗效达96周。
4.儿童接种辉瑞mRNA疫苗临床数据公布。辉瑞和BioNTech公布了mRNA疫苗BNT162b2在5-11岁儿童中开展的Ⅱ/Ⅲ期临床积极数据。完成两剂疫苗接种1个月后,5-11岁儿童体内诱导的SARS-CoV-2中和抗体几何平均滴度 (GMT) 为1197.6,与16-25岁参与者的GMT数据(1146.5)相当;而且疫苗在两个年龄段引发的副作用一致,包括发烧、头痛和疲劳等。另外,临床试验中另外两个年龄组(2-5岁儿童和6个月至2岁儿童)的临床数据预计将于今年第四季度发布。
5.BMS创新LAG-3抗体获FDA优先审评资格。FDA授予百时美施贵宝LAG-3抗体relatlimab优先审评资格,与PD-1抗体Opdivo联用,治疗不可切除/转移性黑色素瘤患者。在一项Ⅱ/Ⅲ期临床中,与安慰剂相比,这一组合疗法显著改善患者的无进展生存期(PFS),两组的中位PFS分别为10.12个月和4.63个月。如果获批,relatlimab有望成为首个获得FDA批准的LAG-3抗体。
6.KRAS抑制剂治疗NSCLC临床积极。Mirati Therapeutics公司口服KRAS G12C抑制剂adagrasib治疗非小细胞肺癌(NSCLC)的Ⅱ期临床获积极顶线结果。在携带KRAS G12C的意向治疗人群分析中,adagrasib达到43%的客观缓解率(ORR)和80%的疾病控制率(DCR)。Adagrasib具有长达24小时的半衰期和血脑屏障渗透性特点,此前已获FDA授予突破性疗法认定。该公司预计在今年第4季度向FDA递交新药申请(NDA)。
7.勃林格殷格翰购入免疫疗法新技术。勃林格殷格翰宣布收购Abexxa Biologics。Abexxa专注于围绕在癌细胞上由非典型主要组织相容性复合体(MHC)I类分子呈现的细胞内抗原,靶向开发创新免疫疗法,以直接杀死肿瘤或通过免疫调节介导肿瘤死亡。Abexxa开发的HLA-E靶向“first-in-class”抗体,旨在阻断HLA-E与自然杀伤细胞和T细胞上表达的抑制性免疫检查点受体NKG2A结合,从而激活自然杀伤细胞和效应T细胞。
医药热点
1.美国:接种疫苗的旅客将可自由入境。根据美国CDC日前发布的新指南,美国自11月初开始对所有完全接种新冠疫苗的外国旅客放宽旅行限制。认可的新冠疫苗,不仅包括在美国获批的疫苗,还包括被世卫组织列为紧急使用但尚未在美国获批的疫苗。目前,已被列入世卫组织紧急使用清单的疫苗有辉瑞疫苗、印度血清研究所疫苗、阿斯利康疫苗、强生疫苗、莫德纳疫苗,以及中国科兴和国药疫苗。
2.甘肃19项措施关爱医务人员。甘肃省印发《甘肃省建立保护关心关爱医务人员长效机制的实施意见》,共涉及8个方面共19项的具体措施。其中,对参加重大自然灾害或突发公卫事件的一线医务人员,要进行及时奖励,在职称评聘中优先申报、优先参评、优先聘任。并开通医务人员家属就医绿色通道,对于医务人员子女教育给予更多帮助关爱。
3.北京9月下旬启动流感疫苗接种。北京市2021年流感疫苗接种工作于9月22日全面启动。此次将延续该市2007年以来的流感疫苗免费接种政策,对60岁及以上京籍老年人和在校中小学、中等专业学校、技工院校学生和重大活动应急保障人员实施免费接种。北京市卫健委提醒,完成新冠疫苗全程接种满14天方能接种流感疫苗。
4.浙江出生缺陷救助新政出台。浙江省卫健委印发出生缺陷(遗传代谢病)救助项目等实施方案。根据方案,“十四五”期间浙江继续实施出生缺陷(遗传代谢病)、先天性结构畸形救助项目,新增功能性出生缺陷救助项目,涵盖208个病种。出生缺陷(遗传代谢病)的救助标准为3000元-10000元;先天性结构畸形的救助标准为3000元-30000元;功能性出生缺陷的救助分为3000元、5000元两档。
评审动态
申请临床:
申请生产:
信达生物的信迪利单抗注射液。
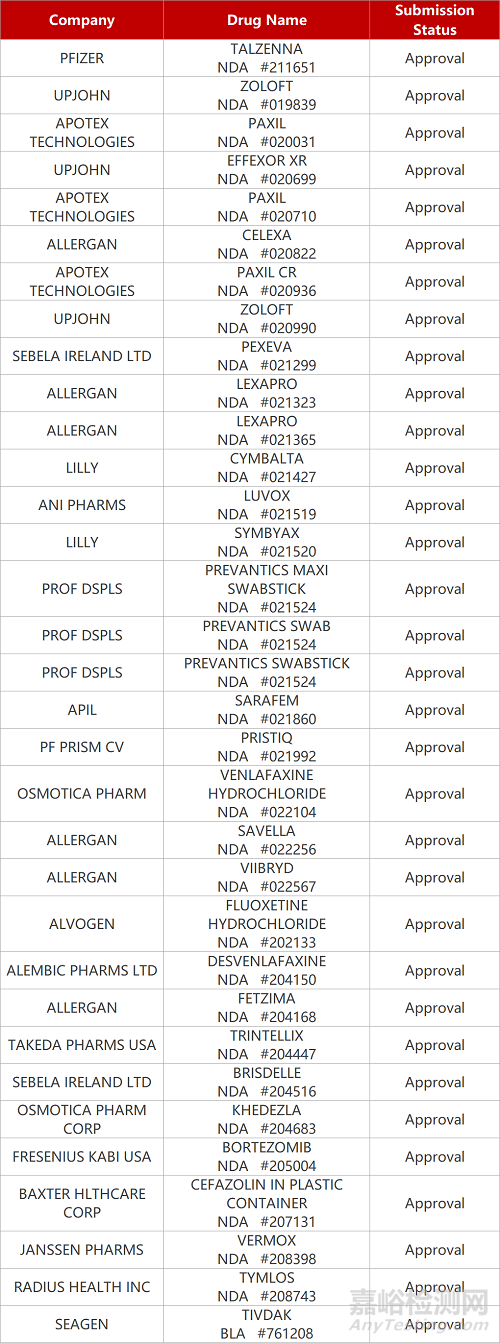
2. FDA新药获批情况(北美09月21日)


来源:药研发


