您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-21 10:53
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
罗氏托珠单抗新适应症免临床极速获批。罗氏托珠单抗注射液新适应症获NMPA批准,用于成年和2岁及以上儿童患者由嵌合抗原受体CAR-T细胞引起的重度或危及生命的细胞因子释放综合征(CRS)。此次托珠单抗免临床试验的极速获批,是基于全球两家CAR-T公司提供的CAR-T细胞疗法治疗血液系统疾病的临床试验数据,其有效评估了罗氏托珠单抗治疗CRS的疗效。这也是托珠单抗在国内获批的第三个适应症。
国内药讯
1.成都倍特富马酸丙酚替诺福韦片首仿获批。成都倍特4类仿制药富马酸丙酚替诺福韦片获国家药监局批准上市,并视同通过一致性评价。富马酸丙酚替诺福韦(TAF)是一种新型核苷类逆转录酶抑制剂(NRTI),由吉利德原研,用于治疗伴有代偿性肝病的慢性乙肝(HBV)感染患者。该药于2018年11月获批进口国内,用于治疗成人和青少年HBV 感染者,商品名韦立得。成都倍特为该品种获批的国内首个仿制药。
2.基石药业PD-L1抗体获FDA孤儿药资格。FDA授予基石药业PD-L1抗体舒格利单抗(CS1001)孤儿药资格,用于治疗T细胞淋巴瘤。这是继7月FDA授予其抗PD-1单抗CS1003用于治疗肝细胞癌的孤儿药资格后,基石药业免疫疗法产品线获得FDA授予的第二个孤儿药资格。在中国,舒格利单抗用于治疗Ⅲ/IV期非小细胞肺癌、胃癌和食管癌已进入Ⅲ期开发阶段。其中该新药治疗IV期非小细胞肺癌的Ⅲ期临床已达到主要终点,预计近期向国家药监局递交新药上市申请。
3.百济神州替雷利珠单抗治疗NSCLC临床新进展。百济神州在NACLC2020年会上公布替雷利珠单抗联合化疗一线治疗晚期鳞状非小细胞肺癌(NSCLC)的Ⅲ期临床最新数据。结果显示,无论PD-L1表达如何,对比仅接受化疗的C组,PFS在联合疗法A组和B组中有大幅度提高(两组均为7.6个月vs5.5个月),同时ORR也有显著提高(A组72.5%,B组74.8%,C组49.6%);替雷利珠单抗联合组中位缓解时间大概是化疗组的两倍;临床中患者通常耐受良好。
4.新旭医药Tau蛋白PET示踪剂在华获批临床。新旭医药创新产品18F-APN-1607注射液获国家药监局一项临床试验默示许可。18F-APN-1607(18F-PMPBB3)是一种PET显像示踪剂,具有在多种Tau蛋白病变相关的疾病中造影出Tau蛋白变异的功能。该产品此前已获FDA授予孤儿药资格。此次为该产品首次在中国获批临床,拟开发用于与Tau蛋白病变相关的阿尔兹海默病(AD)及其他神经退行性病变和认知障碍疾病的诊断和进展程度评估。
5.华东医药与ImmunoGen达成合作许可协议。华东医药宣布其全资子公司中美华东与美国ImmunoGen公司达成独家临床开发及商业化协议。华东医药获得ImmunoGen美国临床Ⅲ期在研产品Mirvetuximab Soravtansine(新型抗体偶联药物ADC,用于治疗卵巢癌)在大中华区(含中国大陆,香港、澳门和台湾地区)的独家临床开发及商业化权益。中美华东将向 ImmunoGen支付4000万美元首付款和最高可达2.65亿美元的里程碑付款,以及约定比例的销售额提成费。
国际药讯
1.阿斯利康Forxiga及Trixeo Aerosphere获CHMP推荐批准。欧洲药品管理局人用药品委员会(CHMP)推荐批准阿斯利康Forxiga(达格列净)扩展适应症,用于无论是否患有2型糖尿病、伴有射血分数降低的症状性慢性心力衰竭成年患者治疗。CHMP同时也推荐批准该公司Trixeo Aerosphere(富马酸福莫特罗/溴化吡喃溴铵/布地奈德)上市,用于未经足够吸入皮质类固醇和长效β2-激动剂(LABA)联合治疗或LABA和长效毒蕈碱拮抗剂联合治疗的中重度慢性阻塞性肺疾病(COPD)成人患者的治疗。
2.默沙东公布Keytruda治疗肺癌的最新进展。默沙东在IASLC 2020会议上公布了PD-1疗法Keytruda治疗晚期非小细胞肺癌(NSCLC)的两项最新结果。其中在KEYNOTE-021研究的G队列中,与化疗相比,Keytruda联合化疗一线治疗提高了患者的客观缓解率(58%vs33%),延长了的无进展生存期(HR=0.54 [95% CI, 0.35-0.83])和维持了患者较长的生存时间获益(HR=0.71 [95% CI, 0.45-1.12])。在Keytruda联合疗法治疗两年的患者中,有92%(n = 11/12)的患者生存时间超过3年,所有12例患者均经历了客观缓解,预计的三年缓解持续时间为100%。
3.强生Tremfya治疗银屑病获长期疗效数据。强生旗下杨森公布IL-23抑制剂Tremfya(特诺雅®,guselkumab)治疗中重度银屑病的Ⅲ期VOYAGE 1研究新的开放标签扩展数据。在第252周,合并Tremfya治疗组中有84%的患者实现PASI90缓解(银屑病面积严重程度指数PASI评分相对基线改善至少90%)、82.4%的患者实现研究者整体评估(IGA)评分为0或1(IGA 0/1:皮损清除或几乎完全清除)。研究264周内观察到的安全性结果与之前研究一致,没有新的安全信号出现。
4.奥希替尼新适应症上市申请获FDA优先审评。阿斯利康奥希替尼(Tagrisso)新适应症的上市申请获FDA优先审评资格,PDUFA日期为2021年第一季度,新适应症为用于根治性肿瘤切除后的早期(IB、II和IIIA)EGFRm突变非小细胞肺癌(NSCLC)患者的辅助治疗。在一项肺癌术后辅助治疗试验(ADAURA)中,奥希替尼的治疗使疾病复发或死亡风险降低了80%。详细结果已发表在《新英格兰医学杂志》上。
5.Opdivo组合疗法获得FDA优先审评资格。FDA分别受理百时美施贵宝(BMS)PD-1抑制剂Opdivo(nivolumab)联合Exelixis公司酪氨酸激酶抑制剂Cabometyx(cabozantinib)治疗晚期肾细胞癌(RCC)患者的补充生物制品许可申请和补充新药申请。FDA同时授予这两个申请优先审评资格,预计明年2月20日前做出回复。在一项Ⅲ期临床CheckMate-9ER中,与活性对照组相比,Opdivo联合Cabometyx将患者死亡风险降低40%(HR=0.60,98.89% CI,0.40,0.89,p=0.0010),将患者无进展生存期(PFS)翻倍(16.6个月vs8.3个月)。
6.CRISPR/Cas9基因编辑疗法在英国获批临床。英国药品和保健产品管理局(MHRA)批准Intellia公司启动Ⅰ期临床试验,评估其基因编辑疗法NTLA-2001治疗遗传性转甲状腺素蛋白淀粉样变性合并多发性神经病(hATTR-PN)的效果和安全性。Intellia 公司由今年诺贝尔化学奖得主之一Jennifer Doudna博士联合创建,专注于利用CRISPR/Cas9系统开发创新潜在的治愈性疗法。这项试验预计注册38例ATTR患者。
医药热点
1.血型可能会影响COVID-19感染严重程度。近日发表于美国血液病学会主办的在线刊物Blood Advances的两项分别在加拿大与丹麦开展的研究结果表明,O型血人士感染COVID-19的风险可能较低;O型血人士如果患病,发生严重后果(包括器官并发症)的可能性也较低。血型在预测COVID-19感染风险和并发症中的潜在作用,已成为一个重要的科学问题。这两项新的研究结果增加了证据,表明血型与易受COVID-19感染之间可能存在关联。
2.韩国17岁男性接种流感疫苗后死亡。据韩媒报道,韩国疾病管理厅厅长郑银敬10月19日表示,一名17岁的男性在接种流感疫苗后死亡,此人于14日接种,16日去世,具体死因正在调查之中。韩国今年实施流感疫苗接种以来,共收到353起异常反应的报告,其中98起是局部反应,99起是过敏反应,79起是发热,69起是其他反应,还有1例死亡事件。尚未确定异常反应与接种疫苗的因果关系,韩国计划通过流行病学调查等进行研究。
3.年底试行医保按病种分值付费。10月19日,国家医保局发布《区域点数法总额预算和按病种分值付费试点工作方案的通知》。《通知》提出,试点工作不再细化明确各医疗机构的总额控制指标,而是把项目、病种、床日等付费单元转换为一定点数,年底根据各医疗机构所提供服务的总点数以及地区医保基金支出预算指标,得出每个点的实际价值,按照各医疗机构实际点数付费。
股市资讯
【复星医药】公司控股子公司Orinove Inc.收到美国FDA关于同意ORIN1001片用于特发性肺纤维化治疗进行临床试验的函。该新药用于晚期实体瘤、特发性肺纤维化治疗。目前,在全球范围内尚无与该新药同类型产品上市。
【和佳医疗】由于广州呼吸中心建设项目医用系统工程建设需要,广州市水电设备安装有限公司预备向公司采购呼吸项目工程洁净区域和国家重点实验室系统所需物资,经协商,达成《广州呼吸中心建设项目医用系统工程物资采购预约合同》。采购总金额暂定为1.36亿元。
【尔康制药】公司全资子公司湖南湘易康制药有限公司的“湘尔康TM75%乙醇免洗手消毒凝胶”和“湘尔康TM75%乙醇消毒液”在全国消毒产品网上备案信息服务平台获得备案登记。
审评动向
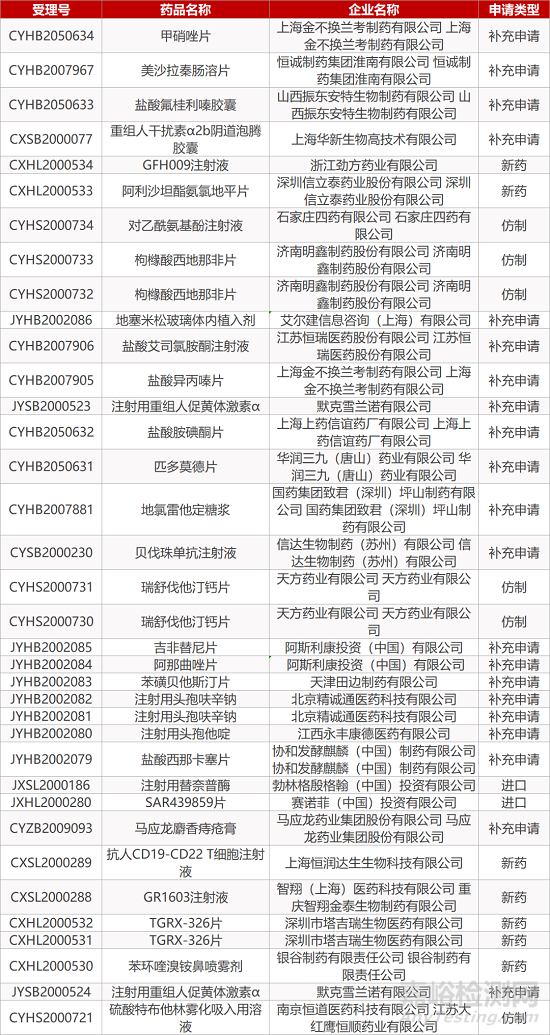
1. CDE最新受理情况(10月20日)
- The End -

来源:药研发


