您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-26 09:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
本文共:15条资讯,阅读时长约:3分钟 」
今日头条
诺华PD-1联合用药方案III期临床失败。诺华在研抗PD-1疗法spartalizumab(PDR001),联合BRAF抑制剂Tafinlar(dabrafenib)和MEK抑制剂Mekinist(trametinib),一线治疗BRAF V600突变阳性、晚期黑色素瘤的III期COMBI-i(NCT02967692)临床未达主要研究终点。与安慰剂+Tafinlar+Mekinist治疗组相比,spartalizumab联合用药治疗组中由研究者评估的无进展生存期没有表现出显著改善。详细结果将于医学会议上公布。Tafinlar和Mekinist均已获批用于治疗BRAF V600突变的晚期黑色素瘤,这两药组合也获批用于这类患者的治疗。
国内药讯
1.云顶新耀合作品种etrasimod启动中国Ⅲ期临床。云顶新耀公司新一代口服S1P受体调节剂etrasimod(APD334)治疗中重度溃疡性结肠炎(UC)的中国Ⅲ期临床正式启动,目前正在招募患者。Etrasimod由合作伙伴Arena公司开发,已在针对中重度UC患者开展的Ⅱ期临床OASIS中达到主要疗效终点。用药1周即观察到大便频率和便血症状的改善,治疗12周后除了临床症状的显著改善外,还观察到组织学的明显改善;而且具良好的安全性和耐受性。
2.海正1类新药HS236胶囊启动临床。海正药业FGFR4选择性抑制剂HS236胶囊登记启动一项I期临床。该研究拟在48例晚期实体瘤患者中评估HS236胶囊的安全性和耐受性,并探索 HS236的最大耐受剂量(MTD),确定Ⅱ期临床试验推荐剂量(RP2D)。FGFR4是受体酪氨酸激酶家族的一员,参与调控细胞增殖、分化、转移和血管形成,其表达异常已被证实与肝细胞肝癌、乳腺癌等多种实体瘤相关。
3.恒瑞苹果酸法米替尼胶囊获批临床。恒瑞医药酪氨酸激酶抑制剂苹果酸法米替尼胶囊获国家药监局三项临床试验默示许可,拟开发用于单药治疗经过伊马替尼治疗失败的晚期胃肠道间质瘤。全球范围内,已有多款同类产品获批上市,包括拜耳的索拉非尼、辉瑞的舒尼替尼和诺华的培唑帕尼。目前这三款多靶点抑制剂均已在国内获批上市。据IQVIA数据库,索拉非尼、舒尼替尼、培唑帕尼的2019年全球销售额约为21.59亿美元。
4.信达生物LAG-3/PD-L1双抗申报临床。信达生物1类生物新药IBI323临床试验申请获CDE受理。这是一款具“first-in-class”潜力的LAG-3/PD-L1双特异性抗体,此次为IBI323首次在中国申报临床,针对肿瘤治疗。此前,它已在临床前研究中显示其体外疗效及体内疗效均优于抗LAG-3单抗与抗PD-L1单抗的联合疗法。值得一提的是,信达生物在研产品中已有一款抗LAG-3单抗IBI110正在进行临床研究,包括单药或与信迪利单抗联合用药治疗晚期恶性肿瘤。
5.百济神州获百奥泰贝伐珠单抗生物类似药中国权益。百奥泰发布公告称与百济神州签署授权、分销、供货协议,将其在研BAT1706(贝伐珠单抗) 相关知识产权及其在中国地区(包括中国大陆、香港、澳门和台湾)的产品权益授权给百济神州。根据协议,百奥泰将获得总金额不超过1.65亿美元款项(首付款、里程碑付款),以及两位数百分比的销售提成。目前,BAT1706的上市申请已获得CDE受理,适应症包括晚期、转移性或复发性非小细胞肺癌和转移性结直肠癌。
6.康乃德生物完成C轮融资。康乃德生物宣布完成1.15亿美元C轮融资,主要用于推进其IL-4Rα单抗CBP-201治疗中重度特应性皮炎的Ⅱ期临床,和加速新型第二代S1P1激动剂CBP-307用于治疗溃疡性结肠炎的Ⅱ期临床,以及治疗中重度克罗恩病的临床开发;同时也将用于扩大CBP-201新适应症的临床开发,以及这两款新药Ⅲ期临床样品的生产。另外,本轮融资还将用于推进一款新型G蛋白偶联受体抑制剂CBP-174进入Ⅰ期临床阶段。
国际药讯
1.默沙东Keytruda在日本斩获两项最新批准。日前,默沙东宣布其PD-1抗体疗法Keytruda获得两项日本医药品与医疗器械局(PMDA)的最新批准。具体为:1)单药用于治疗PD-L1阳性的、无法完全切除的、晚期/复发性食管鳞状细胞癌(ESCC)患者;2)Keytruda额外推荐剂量每六周(Q6W)400mg给药方案获得批准,30分钟以上静注,用于所有获批成人适应症,包括单药疗法与联合疗法。截至目前,Keytruda在日本拥有了针对7种肿瘤以及MSI-H肿瘤的13种适应症。
2.Cabometyx+Opdivo创新免疫组合疗法递交补充申请。Exelixis公司酪氨酸激酶抑制剂Cabometyx(cabozantinib)已向FDA提交了补充新药申请,联合PD-1抑制剂Opdivo用于治疗晚期肾细胞癌(RCC)患者。在一项关键性Ⅲ期临床CheckMate-9ER中,这一组合疗法一线治疗显著改善晚期/转移性RCC患者的无进展生存期(PFS),并且达到了客观缓解率(ORR)和总生存期(OS)的次要终点。FDA此前已批准Cabomety作为单药,治疗晚期RCC和肝细胞癌患者。
3.小野制药BTK抑制剂Velexbru日本获批新适应症。小野制药(Ono Pharmaceutical)BTK抑制剂Velexbru(tirabrutinib)在日本获批新适应症,用于治疗华氏巨球蛋白血症(WM)和淋巴浆细胞性淋巴瘤(LPL)。在一项II期研究ONO4059-05中,Velexbru在初治患者组的ORR达88.9%(95%CI:65.3-98.6)、复发/难治性患者组的ORR达88.9%(95%CI:51.8-99.7)。今年3月,Velexbru已在日本获得全球首批,用于治疗复发/难治性原发性中枢神经系统淋巴瘤(PCNSL),是全球获批用于这类患者的首个BTK抑制剂。
4.Vertex创新三联疗法Kaftrio获欧盟批准。欧盟委员会(EC)宣布批准Vertex制药公司Kaftrio(ivacaftor/tezacaftor/elexacaftor)与Kalydeco(ivacaftor)150mg联合用药方案,用于治疗年龄≥12岁的囊性纤维化(CF)患者(这些患者携带一个F508del突变和一个最小功能突变或携带2个F508del突变)。这款三联疗法已于2019年10月获FDA批准上市,品牌名为Trikafta(elexacaftor/tezacaftor/ivacaftor+ivacaftor)。F508del突变是导致CF的最常见突变,Trikafta的获批将可治疗CF患者扩大至90%,FDA此前已授予Trikafta优先审查资格、快速通道资格、突破性药物资格(BTD)。
5.BMS囊获临床期TGF-β特异性抑制剂。百时美施贵宝(BMS)宣布将收购Forbius公司,获得其主打在研TGF-β抑制剂AVID200。AVID200选择性靶向作用于TGF-β1和TGF-β3的能力使其成为纤维化疾病和免疫肿瘤学中一种有效且耐受良好的治疗药物。选择性抑制TGF-β1和TGF-β3可能通过与免疫疗法之间的协同作用增强抗肿瘤疗效。BMS计划将AVID200的研发工作集中在肿瘤学领域,并考虑将该资产推进到如纤维化等其他疾病领域。
医药热点
1.沪苏浙门急诊就医实现免备案直接结算。8月24日,上海市青浦区、嘉兴市嘉善县、苏州市吴江区三地率先实现长三角一体化示范区医保一卡通“2.0版”,示范区内三地群众看病刷医保卡将更加便捷,异地门急诊就医无需备案即可直接刷卡结算。此外,沪苏浙还率先在示范区内实现了跨省统一医保经办服务,个人参保信息查询、出具《参保凭证》、转移接续手续办理等首批9项服务事项已上线。
2.港大证实有康复者二次感染新冠病毒。8月24日,香港大学研究人员报告发现世界上首个确认被新冠病毒重复感染的病例。据报道,该患者为一名33岁男子,他于今年3月底确诊感染新冠病毒,4月中旬康复出院,8月初经英国到西班牙旅行,返回香港后接受检测再度确诊。香港大学研究人员通过对患者两次感染后获得的样本进行基因组测序,发两次感染的病毒株基因排序有24个不同之处,且该患者体内已检测不出抗体,证实该名患者非“复阳”。
3.韩国首都圈学校暴发集体感染。据韩联社报道,因新冠疫情反弹,韩国副总理兼教育部长官俞银惠25日召开紧急发布会,宣布升级校园防控举措。俞银惠表示,最近2周,首都圈集体感染已造成150名学生和43名教师确诊。她宣布从26日起到9月11日,三周期间内,首都圈所有幼儿园、中小学以及高一、高二的学生,全部转为线上授课。由于高考临近,高三学生继续线下开课。
股市资讯
【康缘药业】公司药品 WXSH0493片收到国家药监局签发的《药物临床试验批准通知书》。
【中国医药】2020半年度实现营业收入188.1亿元(+11.56%);归母净利润7.77亿元(+12.93%);扣非归母净利润7.50亿元(+13.02%)。
【欧普康视】全资子公司欧普投资以自有资金人民币 2,404.29 万元投资莱莱州同明医院,投资完成后,欧普投资将持有其 51%的股权。
审评动向
1. CDE最新受理情况(08月25日)
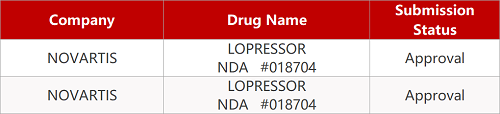
2. FDA最新获批情况(北美08月24日)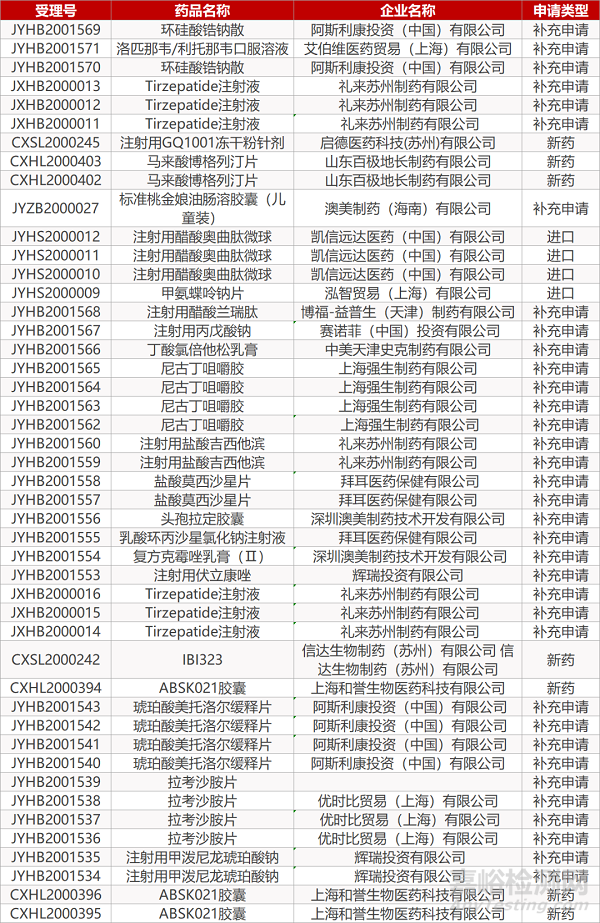
- The End -

来源:药研发


