您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-05 09:12
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
罗氏“不限癌种”疗法Rozlytrek获欧盟有条件批准。欧盟委员会(EC)批准罗氏酪氨酸激酶抑制剂Rozlytrek(entrectinib)有条件上市,用于治疗12岁及以上NTRK融合阳性、晚期复发性实体瘤患者。EC同时还批准了Rozlytrek用于ROS1阳性的晚期非小细胞肺癌成人患者。此次批准基于关键Ⅱ期临床研究STARTRK-2、Ⅰ期临床研究STARTRK-1和Ⅰ期临床研究ALKA-372-001的综合分析结果,以及Ⅰ/Ⅱ期临床研究STARTRK-NG的数据。截至目前,Rozlytrek上述两项适应症已在美国和日本等国家获批上市。
国内药讯
1.上海医药替米沙坦片首家通过一致性评价。上海医药旗下信谊天平药业的替米沙坦片获国家药监局核发的药品补充申请批件,成为该品种首家通过仿制药一致性评价的产品。替米沙坦片主要适用于原发性高血压的治疗,由勃林格殷格翰公司研发,最早于1998年在美国上市。目前,国内该品种获批的生产厂家有勃林格殷格翰、北京福元、万邦生化和宜昌东阳光等。IQVIA数据库显示,2019年该品种口服片剂医院采购金额为人民币55,952万元。
2.泮托拉唑钠肠溶片第二家通过一致性评价。九典制药泮托拉唑钠肠溶片(40mg)获国家药监局核发的药品补充申请批件,成为该品种继康恩贝之后第二家通过一致性评价的产品。泮托拉唑钠肠溶片是第三代新型质子泵抑制剂,主要用来治疗十二指肠溃疡、胃溃疡、中重度反流性食管炎等。原研产品由德国百克顿公司研制,并于1994年首次在德国上市,商品名为潘妥洛克(Pantoloc®)。2019年泮托拉唑口服制剂国内零售和医疗终端市场销售额约为25亿元。
3.齐鲁枸橼酸西地那非片即将获批。齐鲁制药4类仿制药枸橼酸西地那非片的上市申请审评状态变更为“在审批”,有望近期获批上市并视同通过一致性评价。枸橼酸西地那非片是一种PDE-5选择性抑制剂,用于治疗性功能勃起障碍。米内网数据显示,2019年中国城市零售药店终端西地那非销售额超过23亿元,同比增长7.42%。其中,白云山制药总厂市场份额位列第一,原研厂家辉瑞紧跟其后。
4.科伦药业LAG-3单抗获批临床。8月3日,科伦博泰/安源医药申报的LAG-3抗体KL-A289注射液获国家药监局临床试验默示许可,用于晚期实体瘤。LAG-3 (淋巴细胞激活基因3,CD223) 是一种复合物结合的免疫检查点受体,表达于活化的T细胞、NK细胞、B细胞和浆细胞样树突状细胞上。抑制LAG-3能够让T细胞重新获得细胞毒性,增强对肿瘤的杀伤效果,同时降低调节T细胞抑制免疫反应的功能。目前全球有多家企业布局LAG-3,其中7款为靶向LAG-3和PD-1/PD-L1/CTLA4的双靶点药物,进展较快的为BMS的BMS-986213,已进入Ⅲ期临床。
5.信达三款抗肿瘤新药临床申请获受理。8月4日,信达生物三款抗肿瘤新药的临床试验申请获CDE受理,包括PD-1信迪利单抗注射液,CTLA-4抗体IBI310以及抗肿瘤生物新药IBI102。其中,IBI102为首次在中国申报临床。根据药物临床试验登记与信息公示平台,信迪利单抗登记开展了5项临床试验,除了已获批适应症,该产品还在开展针对非鳞状非小细胞肺、肝细胞癌、晚期恶性肿瘤等癌种的临床研究;IBI310登记开展了5项临床试验,适应症包括肝细胞癌、黑色素瘤、微卫星高度不稳定性(MSI-H)或错配修复缺陷(dMMR)型晚期结直肠癌等。
6.先声获得肿瘤新药CDK4/6抑制剂独家许可。肿瘤学公司G1 Therapeutics与先声药业就G1公司拟用于改善癌症化疗患者预后的CDK4/6抑制剂trilaciclib,在大中华区(中国大陆,香港,澳门和台湾地区)所有适应症的开发和商业化达成独家授权协议。2020年6月,G1已向FDA提交了trilaciclib用于小细胞肺癌患者骨髓保护的新药上市申请。根据协议,G1公司将获1400万美元的预付款,高达1.56亿美元的开发和商业里程碑付款以及产品的销售分成。此外,先声药业可参与trilaciclib的全球临床试验,两家公司将负责各自领域内的所有开发和商业化成本。
国际药讯
1.礼来联合启动中和抗体Ⅲ期预防性研究。礼来和AbCellera公司联合开发的新冠病毒中和抗体LY-CoV555宣布启动Ⅲ期临床BLAZE-2。抗体在人体中的半衰期比较长,一次输注之后,它们可以在人体内存留几周甚至几个月的时间,为接受注射的人群提供被动免疫力。这项试验将在出现过COVID-19病例的疗养院中进行,预计入组2400名老年人和医护人员,评估一剂LY-CoV555在4周内是否降低新冠病毒感染率,以及一剂在8周内是否降低COVID-19相关的并发症。
2.武田、艾伯维、安进开展COVID-19适应性平台试验。COVID研发联盟成员艾伯维、安进和武田宣布,名为I-SPY COVID的适应性平台试验注册了首例COVID-19严重住院患者,这项研究将评估CCR2/CCR5双重拮抗剂cenicriviroc,PDE4抑制剂Otezla(apremilast),和缓激肽B2受体拮抗剂Firazyr(icatibant)的疗效。据悉这一研究是COVID研发联盟成员和Quantum Leap公司以及FDA的合作项目,它使用了Quantum Leap公司的适应性平台试验设计,旨在通过最小化参与临床试验的人数和评估潜在疗法的所需时间,提高临床试验的效率。
3.杨森创新鼻喷剂获FDA批准治疗抑郁症患者。FDA批准杨森公司NMDA受体拮抗剂鼻喷雾剂Spravato(esketamine)CIII的补充新药申请,与口服抗抑郁药联用,治疗伴有急性自杀念头或行为的抑郁症(MDD)成人患者的抑郁症状。Spravato也是唯一一个FDA批准的在24小时内显示减轻抑郁症状的药物。在两项试验中,Spravato联合综合标准治疗组24小时后的MADRS抑郁评定量表评分下降了15.9和16.0分,而安慰剂加综合标准治疗组仅降低了12.0和12.2分;Spravato组的临床缓解率为41%和43%,而安慰剂组这一数值为34%和27%。
4.杨森达雷木单抗三联疗法达Ⅲ期临床终点。杨森与欧洲骨髓瘤网络(EMN)合作报告了Ⅲ期临床研究APOLLO(MMY3013)的积极结果。该研究评估了达雷木单抗(Darzalex)皮下(SC)剂型联合泊马度胺(pomalidomide)和地塞米松(dexamethasone)(简称Pd)对比单独使用Pd,用于复发/难治多发性骨髓瘤患者的有效性和安全性,这些患者曾接受过来那度胺和蛋白酶体抑制剂(PI)治疗。结果显示,研究达到了提高无进展生存率(PFS)的主要终点;且两种疗法的安全性相一致。
5.创新双重mTOR抑制剂获FDA孤儿药资格。Cerecor公司双重mTOR小分子抑制剂CERC-006获FDA授予孤儿药资格,用于治疗淋巴管畸形(LM)。LM是一种罕见的非恶性肿块,常导致附近结构或器官的功能损伤。淋巴管畸形患者通常沿着PI3K/AKT/mTOR通路存在激活突变,目前主要治疗方法有经皮穿刺引流、外科手术、硬化治疗、激光治疗、射频消融或药物治疗。CERC-006可最大化mTOR抑制的影响,有潜力改善治疗LM的安全性和疗效。Cerecor计划在2020年末启动其在LM患者中的Ⅰb/Ⅱa期概念验证研究。
医药热点
股市资讯
【泽璟制药-U】获批开展甲苯磺酸多纳非尼片与KN046注射液联合治疗晚期消化道实体瘤的临床试验。
【科伦药业】控股子公司与安源医药共同开发的创新肿瘤免疫药物KL-A289注射液获国药监局临床试验通知书。
【昆药集团】截至2020年7月31日,公司通过集中竞价累计回购512万股,占总股本0.67%,最高价10.67元/股、最低价9.47元/股,支付资金5,200.42万元。
审评动向
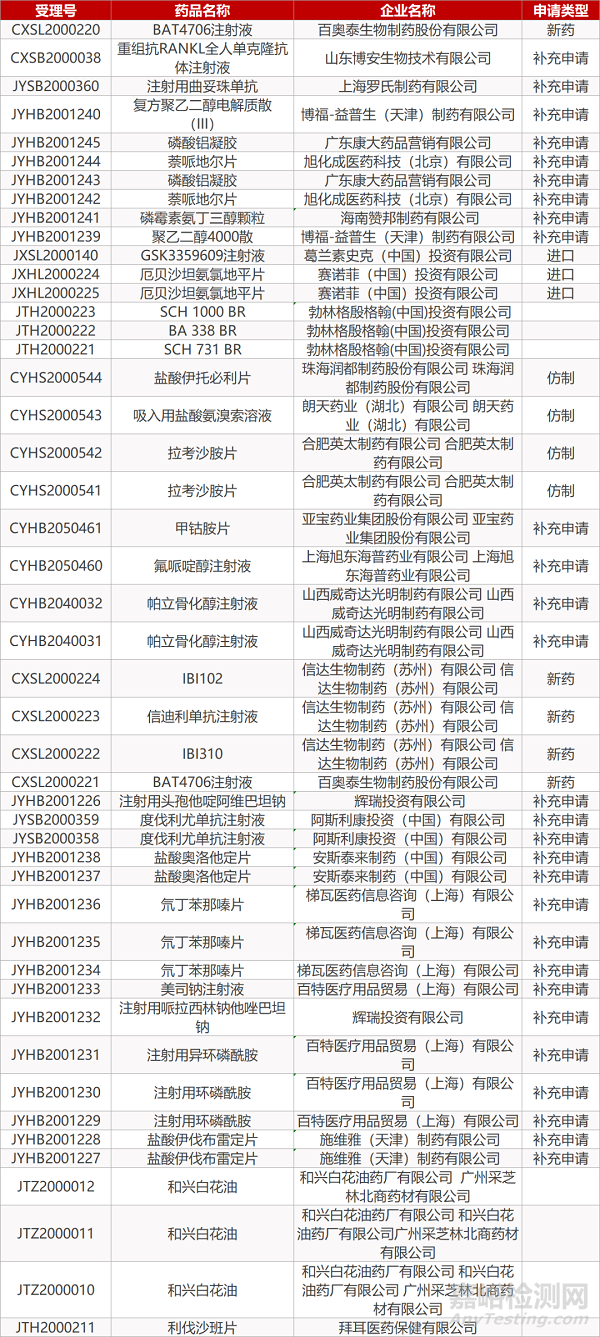
1. CDE最新受理情况(08月04日)
2. FDA最新获批情况(北美08月03日)

- The End -

来源:药研发


