您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-21 09:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
李氏大药厂PD-L1在中国申报突破性治疗药物认定。7月17日,李氏大药厂发布公告称,其旗下中国肿瘤医疗有限公司已向NMPA提交申请,以认定其PD-L1单抗ZKAB001用于治疗复发及转移性宫颈癌的突破性治疗药物。ZKAB001是一款PD-L1抑制剂,目前正在中国开展针对宫颈癌的Ⅰ期临床试验。根据公开信息推测,ZKAB001的突破性治疗药物申请,可能是NMPA几日前公布《突破性治疗药物审评工作程序(试行)》后,收到的首份突破性治疗药物申请。
国内药讯
1.抗肿瘤药联合治疗临床指导原则发布。7月17日,CDE发布关于公开征求《抗肿瘤药联合治疗临床试验技术指导原则》意见的通知。该指导原则讨论的是以提高疗效为主要目标的抗肿瘤药联合治疗的临床试验设计,指导原则依据不同的联合治疗临床试验阶段,阐述抗肿瘤药联合治疗开发的试验设计原则和获益评价,以期为抗肿瘤药联合治疗开发提供参考,科学有序研发。
2.石药甲磺酸伊马替尼片通过一致性评价。7月20日,石药集团甲磺酸伊马替尼片通过一致性评价。伊马替尼是一种口服的酪氨酸激酶抑制剂,用于一线治疗慢性髓性白血病(CML)患者,能使CML患者的10年生存率提高到85%~90%。原研产品由诺华开发,于2001年5月获FDA批准上市,于2002年4月获批进入中国,商品名为格列卫。2019年格列卫销售额为12.63亿美元。国内除原研诺华外,获批的生产厂家还有豪森、正大天晴和石药集团。
3.泰飞尔关节炎创新药X0002获FDA快速审评。泰飞尔公司宣布FDA授予其非选择性COX抑制剂X0002快速审评资格,用于缓解骨关节炎(OA)和慢性腰背疼(CLBP)引起的慢性疼痛和改善关节功能。在I期和II期临床中,X0002的疗效显示出剂量相关性,在WOMAC(VAS)疼痛、僵直、功能量表评分和总评分达统计学意义的显著改善,临床中无与X0002相关的不良反应报告。目前X0002在美国已启动两项III期临床评估用于OA和CLBP的疗效。
4.箕星药业与Cytokinetics公司达成合作。RTW Investments公司旗下箕星药业与Cytokinetics公司就新一代心肌肌球蛋白抑制剂CK-274在大中华区的研发和商业化签订了独家许可协议。Cytokinetics是一家致力于研发“first-in-class”肌肉激活剂和“next-in-class”肌肉抑制剂,并将其商业化的临床后期阶段生物制药公司。CK-274是由Cytokinetics科学家独立研发,拟用于治疗肥厚性心肌病的一种口服小分子新型药物,根据协议,箕星药业将向Cytokinetics支付预付款,可能高达2亿美元的研发和商业化里程碑付款以及产品销售提成。据悉,两家公司还签订了更深入的战略融资协议和股权购买协议。
5.云顶新耀申请在港交所IPO。7月20日,云顶新耀向港交所递交上市申请,高盛及美银为联席保荐人。云顶新耀创立于2017年,是一家专注于创新药开发及商业化的生物制药公司。该公司目前拥有八个潜在全球首创或同类最佳的分子组合。本次募资将用于四款主要产品的临床试验及后续商业化:抗Trop-2抗体药物偶联物Sacituzumab govitecan、广谱四环素类非肠道抗生素Xerava、第二代S1P受体口服调节剂Etrasimod、布地奈德的口服靶向释放制剂Nefeco,以及其他项目早期临床试验开发。
国际药讯
1.Blueprint靶向抗癌药Pralsetinib在美申报新适应症。Blueprint Medicines公司已向FDA提交了在研口服RET抑制剂pralsetinib的新药上市申请, 用于治疗晚期或转移性RET突变甲状腺髓样癌和RET融合阳性甲状腺癌患者。Blueprint公司正在进行pralsetinib的多项临床开发,包括用于治疗RET变异的非小细胞肺癌、甲状腺癌和其他实体瘤患者。其中,非小细胞肺癌的适应症已递交FDA上市申请,且获得FDA突破性疗法认定。基石药业拥有pralsetinib在大中华区的独家开发和商业化授权。
2.达格列净获FDA快速通道资格。FDA授予阿斯利康SGLT2抑制剂达格列净(Farxiga)快速通道资格,用于降低成年患者因急性心肌梗死(MI)或心脏病发作而引发的心力衰竭住院(hHF)风险或心血管(CV)死亡风险。此次授予基于一项名为DAPA-MI的Ⅲ期临床试验,该研究旨在评估Farxiga降低无2型糖尿病的成年患者急性心肌梗死后发生hHF和CV疾病风险的疗效和安全性,计划从瑞典和英国招募6400例患者,预计将于今年第四季度开始招募。
3.再生元IL-1抑制剂获FDA孤儿药资格。FDA授予Kiniksa Pharmaceuticals与再生元联合开发的IL-1抑制剂rilonacept孤儿药资格,用于治疗复发性心包炎。Rilonacept是一种每周一次、皮下注射的重组融合蛋白,可阻断IL-1α和IL-1β信号。该药物最初由再生元发现和开发,并获得FDA批准(商品名:Arcalyst)用于治疗与冷吡啉(Cryopyrin)相关周期性综合征。Kiniksa公司于2017年从再生元获得rilonacept的许可,用于研究由IL-1α和IL-1β介导的疾病(包括心包炎)。2019年,rilonacept还获得了FDA治疗复发性心包炎的突破性疗法认定。
4.吉利德出售SYK抑制剂资产。Kronos Bio与吉利德达成一项协议,收购吉利德的脾脏酪氨酸激酶(SYK)抑制剂资产组合。其中有两款SYK抑制剂处于临床开发阶段,一款为拟用于治疗血液系统恶性肿瘤的entospletinib,另一款为拟用于治疗炎症性疾病的lanraplenib。针对SYK抑制剂,Kronos Bio计划聚焦于一个由生物标志物定义的急性髓细胞白血病(AML)患者亚组。有证据表明,在癌症过度表达HOXA9和MEIS1转录因子的少数患者中,SYK是一个关键靶点。
5.强生2020半年报公布。强生公布2020上半年业绩,营收390.27亿美元,同比下滑3.8%。其中,制药业务营收218.86亿美元,同比增长5.4%;消费者保健业务营收为69.21亿美元,同比增长0.9%;医疗器械业务营收102.2亿美元,同比下滑21.1%。制药业务方面,强生在免疫领域共营收71.61亿美元,同比增长6.6%;抗感染领域营收17.98亿美元,同比增长5.3%;精神疾病领域营收32.45亿美元,同比增长2.5%;肿瘤领域营收58.04亿美元,同比增长11.3%;肺动脉高压领域营收15.34亿美元,同比增长13.9%;心血管/代谢/其他领域营收23.44亿美元,同比下滑-10.5%。
6.生物制药领域新药研发项目价值top10排名。全球知名咨询公司Evaluate旗下EP Vantage近日发布报告,对生物制药领域最有价值的新药研发项目进行了预测,排位top10的药物分别为:礼来的GIP/GLP-1双重受体激动剂Tirzepatide、诺华的首创siRNA降胆固醇药物Inclisiran、Argenx公司的首创FcRn抗体Efgartigimod、BMS的选择性TYK2抑制剂BMS-986165、Vir Biotechnology的乙肝RNAi疗法ALN-HBV02、渤健/卫材的β淀粉样蛋白靶向单抗药物Aducanumab、葛兰素史克的BCMA抗体药物偶联物(ADC)Belantamab Mafodotin、Iovance Biotherapeutics的自体TIL疗法LN-144、Allakos的抗SIGLEC-8单抗AK002、罗氏的SMN2剪接修饰剂Risdiplam。
医药热点
1.澳大利亚新冠病毒快速检测法20分钟出结果。近日,澳大利亚莫纳什大学领导的研究团队提出了一种基于血液样本的检测方法,可以在大约20分钟内确定个体被新冠病毒的感染情况。据悉,该方法是一种基于常用血型分型法的凝集试验。研究团队通过柱状凝集试验与肽-抗体生物偶联物相结合,描述凝集试验在新冠病毒血清学检测中的应用。该研究近日已发表在ACS Sensors上。
2.医联体管理办法8月1日起施行。近日,国家卫健委、国家中医药管理局联合发布《医疗联合体管理办法(试行)》,《办法》自今年8月1日起施行。《办法》强调,医联体牵头医院应当逐步减少常见病、多发病、病情稳定的慢性病患者比例,主动将急性病恢复期患者、术后恢复期患者及危重症稳定期患者及时转诊至下级医疗机构继续治疗和康复,为患者提供疾病诊疗—康复—长期护理连续性服务。
3.北京协和医学院新增两个学院。日前,北京协和医学院在原公共卫生学院的基础上新设2个公卫学院,即群医学及公共卫生学院、卫生健康管理政策学院。其中,群医学及公共卫生学院首任院长由中国工程院副院长、中国医学科学院-北京协和医学院校长王辰兼任,杨维中任执行院长。“群医学”是指根据不同群体健康和疾病的差异特点,应用多学科技术和方法,研究影响人群健康的相关因素,对某个群体疾病进行的防诊治活动。
股市资讯
【恒瑞医药】(1)卡瑞利珠单抗联合化疗对比安慰剂联合化疗新辅助治疗早期或局部晚期三阴性乳腺癌的双盲、随机、平行对照、多中心的 III 期临床研究获得临床批件;(2)吡咯替尼修订说明书的补充申请获得批准,本品联合卡培他滨,适用于治疗表皮生长因子受体 2(HER2)阳性、接受过曲妥珠单抗的复发或转移性乳腺癌患者的适应症转为完全批准。
【药明康德】发布2020年半年度业绩快报,2020上半年实现收入72.31亿元(+22.68%),归母净利润17.17亿元(+62.49%),扣非归母净利润11.31亿元(+13.91%);2020Q2实现营收40.44亿元(+29.41%),归母净利润14.14亿元(+111.46%),扣非归母净利润7.55亿元(+51.67%)。
【国药一致】控股子公司国大药房拟通过公开摘牌方式受让成大方圆医药集团有限公司 100% 股权,成大方圆2019年实现营业收入29亿元,净利润-9238万元。
审评动向
1. CDE最新受理情况(07月20日)
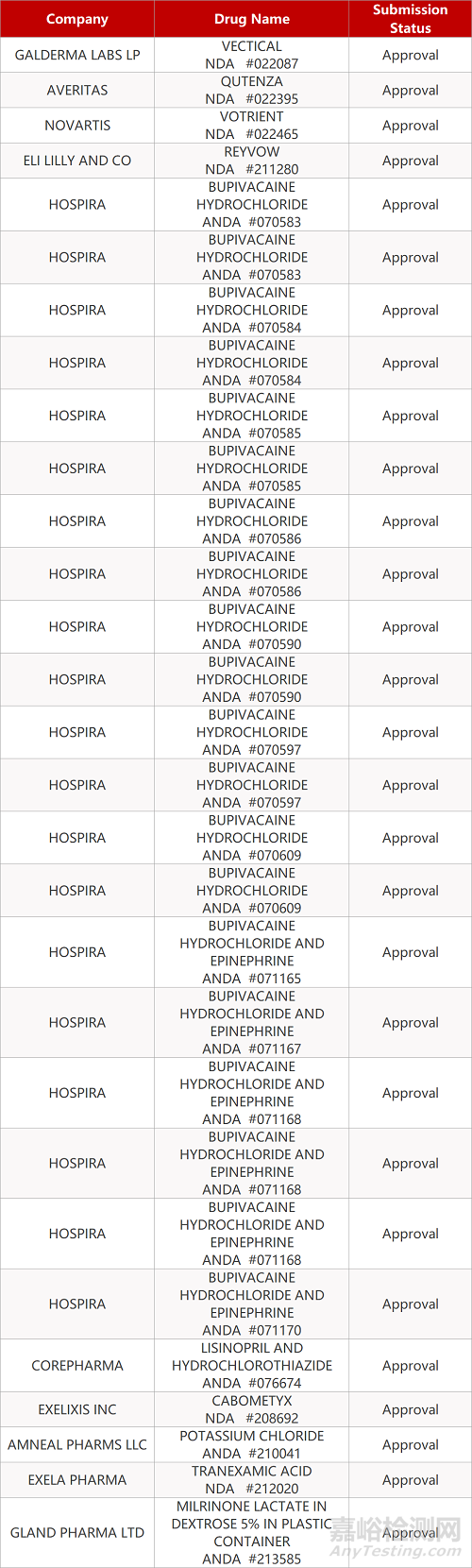
2. FDA最新获批情况(北美07月17日)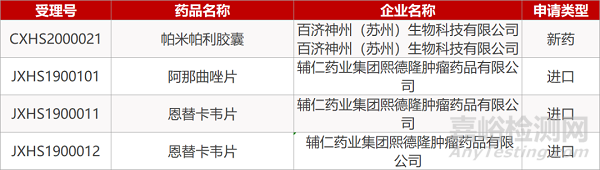
- The End -

来源:药研发


